3.3.4. Законы роста оксидных пленок на металлах
В зависимости от ионной и диффузионной подвижности ионов металла и окислителя, фронт коррозии (условная линия химического взаимодействия), может находиться на внешней стороне пленки, внутри пленки или на границе раздела металл – пленка.
Процесс роста пористой
пленки не осложняется процессом подвода окислителя к поверхности металла, а контролируется скоростью химической реакции образования оксида. Скорость коррозии в этом случае выражается уравнением:
![]() , (3.26)
, (3.26)
где x - толщина пленки; ф – время; K - константа скорости химической реакции образования окcида; C0 - концентрация окислителя на поверхности метала.
После разделения переменных:
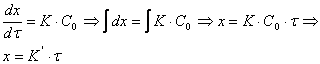 , (3.27)
, (3.27)
то есть рост пористой пленки, контролируемый скоростью химической реакции окисления металла, протекает во времени по линейному закону.
Линейный закон роста имеет место:
- при высокотемпературном окислении в воздухе и кислороде металлов при
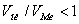 ;
; - в случае образовании летучих оксидов.
Сплошные пленки, затрудняют проникновение реагентов друг к другу и их рост сопровождается самоторможением процесса. Результирующая скорость этого сложного процесса определяется скоростью самой медленной стадии, то есть возможны различные варианты контроля течения процесса.
Первый вариант
Скорость коррозии контролируется стадией массопереноса (диффузионный контроль процесса). В этом случае:
![]() поэтому
поэтому
![]() и для
и для ![]() ,
,![]() , решение которого позволяет получить уравнение параболического закона роста оксидной пленки
, решение которого позволяет получить уравнение параболического закона роста оксидной пленки ![]() и окончательно
и окончательно
![]() , (3.28)
, (3.28)
где в - коэффициент массопереноса; C0 - концентрация реагента (окислителя) в газовой фазе; D - коэффициент диффузии реагента;
Следует особо подчеркнуть, что концентрация окислителя на границе раздела металл – оксидная пленка
(Сх) равна нулю, так как скорость химической реакции весьма велика.
Параболический закон роста реализуется, в частности, при окислении железа на воздухе при различных температурах.
Второй вариант.
В предыдущем случае ![]() то есть накопление окислителя на внутренней поверхности оксидной пленки не происходит. Возможность кинетического торможения процесса роста оксидной пленки наряду с торможением на стадии массопереноса (диффузионно-кинетический контроль процесса) приводит к соотношению:
то есть накопление окислителя на внутренней поверхности оксидной пленки не происходит. Возможность кинетического торможения процесса роста оксидной пленки наряду с торможением на стадии массопереноса (диффузионно-кинетический контроль процесса) приводит к соотношению:
![]() (3.29)
(3.29)
Решение (3.29) приводит к сложно-параболическому закону роста оксидной пленки:
![]() . (3.30)
. (3.30)
Рост оксидных пленок по сложно-параболическому закону выполняется:
- при окислении железа в парах воды или в атмосфере
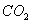 ;
; - при окислении
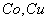 в атмосфере чистого кислорода;
в атмосфере чистого кислорода; - при частичном разрушении оксидной пленки.
Рост оксидных пленок при диффузионно-кинетическом контроле может быть выражен также степенным законом:
![]() , (3.31)
, (3.31)
где n – не равно 2.
Третий вариант
Часто рост пленки протекает медленнее, чем это следует из параболического закона роста. Это наблюдается при возникновении оксидных пленок при низких температурах (на ![]() в
в ![]() при
при ![]() оС; на
оС; на ![]() в О2
в О2
при ![]() оС.)
оС.)
Затухание объясняется либо уплотнением пленок, либо появлением дефектов (пузырей, расслоений). В этих случаях рост пленки протекает в соответствии с логарифмическим законом роста:
![]() . (3.32)
. (3.32)
В заключение, можно отметить общую для большинства металлов тенденцию к снижению самоторможения процесса окисления во времени с ростом температуры: логарифмический закон Þ обратный логарифмический закон Þ степенной (n>2) закон Þ параболический закон Þ сложно-параболический закон Þ линейный закон.
Если металл образует с окислителем несколько устойчивых химических соединений, то образуются многослойные толстые пленки. При этом концентрация металла убывает от границы раздела фаз металл – пленка, а концентрация окислителя возрастает. Примером таких пленок могут быть пленки вида: Cu|Cu2O|CuO|O2; Fe|FeO|Fe3O4|Fe2O3|O2; Mn|MnO|Mn3O4|O2.
Рост слоев происходит вследствие диффузии ионов металла и окислителя; движущей силой является разность химических потенциалов крайних фаз указанных гальванических элементов. Наблюдаемые сложные зависимости скорости роста слоев таких пленок чаще всего объясняются соотношением коэффициентов роста отдельных слоев.
С ростом толщины пленки, возникающие внутренние напряжения могут приводить к образованию трещин и скалыванию пленок и окисление опять будет происходить с начальных стадий.
В ряде случаев обнаруживается двухслойность однофазной пленки (окалины). Приэтом металл в оксиде проявляет одну (низшую) валентность (NiO, Cu2O).
Окалина (пленка), которая представляет собой один и тот же оксид, состоит из двух слоев: внутреннего (пористого) и наружного (плотного, компактного).
Двухслойность объясняется одновременной встречной диффузией металла и окислителя. Наружный слой образуется за счет диффузии металла наружу, а внутренний − следствие диффузии окислителя внутрь.











