Производство первичного алюминия. Электролиз гидроокиси алюминия
Производство первичного алюминия во всем мире основано исключительно на электролизе глинозема в плавильных печах при помощи процесса Хола-Герольта с 1886 года. Плавильные печи для производства первичного алюминия потребляют большое количество электрической энергии, в среднем 13-14 кВтчас/кг алюминия. Энергия, полученная с гидроэлектростанций, является дешевой и экологически чистой. Плавильные печи в Канаде, Венесуэле и Бразилии используют в основном энергию данного источника.
Основные положения
Производство алюминия путем электролиза водного раствора невозможно из-за высокого отрицательного электродного потенциала. Алюминий менее инертен, чем водород, поэтому образования водорода не избежать перед получением алюминия. Низкое водородное перенапряжение усугубляет положение, в то время как при получении прочих неблагородных металлов, например цинка, образования водорода можно избежать при высоком водородном перенапряжении.
В данном случае осаждение металла производится при низкой температуре несмотря на стандартный отрицательный электродный потенциал. С другой стороны, низкое водородное перенапряжение алюминия предотвращает образование водорода. Данное явление не имеет решающего значения при производстве металла. В данном случае электролиз на расплавленных солях является отличной альтернативой, если металлический компонент, который подвергается электролизу, характеризуется низкой точкой плавления, или если точка плавления может быть снижена путем добавления подходящей соли для формирования эвтектической смеси.
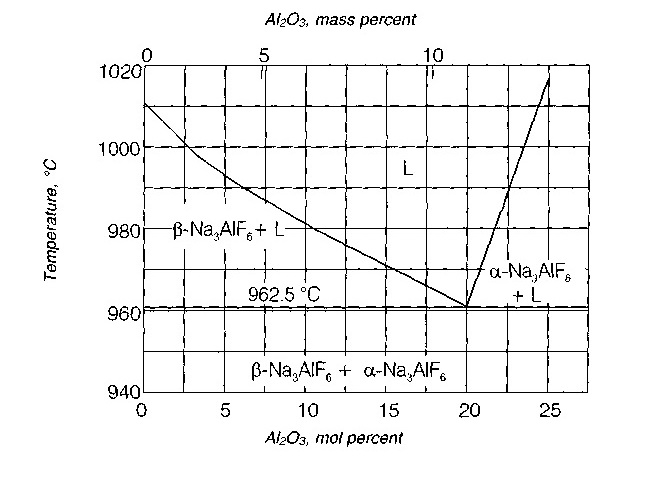
Оксид алюминия характеризуется высокой точкой плавления на уровне примерно 2050°C. Однако, если его растворить в расплавленном криолите (Na3AIF6), образуется эвтектика с точкой плавления на уровне 962.5°C (10.5 % Al2O3, как показано на рисунке. Растворив оксид в расплавленном криолите и добавив небольшое количество других флюсов, можно провести электролиз при температуре 950-980°C. На установках электролиза содержание Al2O3 поддерживается на самом низком уровне (< 2%) при помощи компьютеризированной системы контроля каждой электролитической ванны или ячейки.
Герольт определяет электролиз на расплавленных солях как «электролиз глинозема, который растворяется в расплавленном криолите Na3AIF6 , с использованием углеродного тигеля в качестве катода, на котором накапливается расплавленный алюминий».
Схема фаз равновесия Na3AIF6- Al2O3
Электролиз осуществляется в стальной оболочке с углеродной облицовкой, которая также служит катодом. Шины под ячейкой подают питание на катод. Ванна содержит электролит и расплавленный алюминий, край твердого (или застывшего) электролита образуется на поверхности возле стенок. Углеродные аноды закрепляются на анодные шины и опускаются в электролит.
Электролиз глинозема осуществляется при помощи углеродных электродов, которые вступают в реакцию с кислородом, образующимся на анодах, в результате чего образуется диоксид углерода СО2 или моноксид углерода CO. Процесс электролиза отображается следующей формулой
2AI2O3 + 3C -> 4AI + 3CO2
На электродах происходят две основные реакции:
- на катоде алюминий теряет свой электрический заряд 2AI3+ + 6e -> 2AI
- ионы кислорода перемещаются на катод и вступают в реакцию с углеродом катода, образуя СО2. Это влечет за собой износ анода.
Исследования процессов во время электролиза проводятся постоянно, однако до сих пор механизм отделения металла во время электролиза не был понят до конца. Расплавленный электролит Na3AIF6 существует в диссоциированной форме, в основном в виде AlFe3- и Na+, а также в меньшем объеме в виде AIF4- и F-. Возможно, оксид распадается с образованием оксо-фторидных ионов, например AlFe63-. Отложение алюминия на катодах, по крайней мере частично, осуществляется сначала с образованием натрия, а затем натрий вступает в реакцию с составными элементами электролита. Кислород, образующийся на аноде, вступает в реакцию с углеродом, образуя СО2, несмотря на формулу Будуара (СО2 + C — > 2CO). Практически, однако, выхлопные газы во время процесса электролиза содержат CO (CO/(CO + СО2)) в количестве 10-20%, в основном благодаря обратной реакции алюминия с СО2 (3 СО2 + 2AI -> 3CO + AI2O3), которая понижает эффективность процесса.