8.1. Действие кислорода на полимеры. Окисление и окислительная деструкция
Как уже указывалось, процессы разрушения молекул полимеров сильно ускоряются в присутствии кислорода. Термоокислительная деструкция представляет собой одновременное действие тепла и кислорода. Как правило, она является причиной быстрого выхода полимерных изделий из строя. Скорость термоокислительного распада полимеров обычно выше скорости их чисто термического распада. Для полимеров на углеводородной основе это служит причиной снижения предельных рабочих температур их эксплуатации (до 120-150°С). Процессы термоокислительной деструкции полимеров очень сложны по химической природе. Поэтому изучение их проводилось с помощью модельных низкомолекулярных углеводородов и других соединений.
По представлениям Н. Н. Семенова о цепных реакциях в химии разработаны теории окисления низкомолекулярных углеводородов. В настоящее время твердо установлено, что термоокислительная деструкция полимеров протекает по механизму цепных реакций с вырожденными разветвлениями. В развитии цепных реакций окисления основная роль принадлежит перекисным и гидроперекисным соединениям, которые образуются на первых стадиях взаимодействия кислорода с полимером, так как, будучи неустойчивыми, они быстро распадаются на свободные радикалы и дают начало новым цепям окислительных реакций. Такие реакции с выделением различных промежуточных продуктов подробно изучены на примере окисления газообразных низкомолекулярных углеводородов, и их достаточно надежно можно применять при изучении окисления полимеров в конденсированной фазе. На основе представлений о цепных реакциях была экспериментально доказана схема развития цепных реакций окисления полимеров, которая плодотворно применяется при изучении процессов термоокислительной деструкции различных полимеров.
Как и все цепные реакции, эта схема включает стадии инициирования, роста и обрыва кинетической цепи окислительных реакций. Стадия инициирования связана с распадом гидроперекисей, образующихся на начальном этапе взаимодействия кислорода с полимером. Если обозначить молекулу углеводородного полимера RH (указав тем самым на наличие подвижного атома водорода в его макромолекуле), то общая схема реакций окисления будет выглядеть следующим образом:
Инициирование и разветвление: RH -> R· + H·; RH + О2 -> ROOH; ROOH -> RO· + ОН·; 2ROOH -> RO· + RO2· +H2O;
ROOH + RH ->R·+ RO· + H2O; RH + O2 -> R· + HO2·
Рост цепи: R· + O2 -> RO2·; RO2 + RH -> ROOH + R·
В процессе роста цепи вновь образуются малоустойчивые гидроперекиси, которые приводят к развитию реакций разветвления цепи:
ROOH ->
RO· + ОН·; RO· + RH -> ROH + R·; ОН· + RH -> R· + Н2O
Обрыв цепи происходит в результате столкновения двух радикалов и образований неактивных продуктов при их взаимодействии:
2R· -> R-R; R· + RO2· -> ROOR; RO· + R· -> ROR
сшивка перекись эфир
2RO2· -> R-O-O-R + O2
перекись
Таким образом, процесс окисления полимеров характеризуется признаками цепных радикальных реакций. Так, на кинетической кривой присоединения кислорода к полимеру имеется индукционный период, величина которого может быть увеличена в присутствии ингибитора (рис. 67).
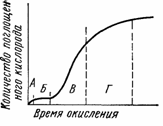
Рис. 67. Кинетическая кривая окисления полимеров:
А — быстрое начальное окисление по активным группам в полимере; Б — индукционный период (ингибированное окисление); В — автокатализ — резкое увеличение скорости в цепном процессе; Г — стадия снижения скорости окисления
Окисление ускоряется также при освещении, причем после удаления источника света имеется так называемый «постэффект» действия света (рис.68).
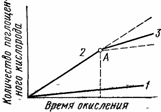
Рис. 68. Влияние солнечного света на окисление полимеров при низких температурах: 1 — окисление в темноте; 2 — окисление на свету; 3 — окисление после удаления источника света (Л)
При повышении температуры индукционный период сокращается, а скорость окисления возрастает (рис.69).
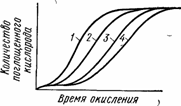
Рис. 69. Кинетические кривые окисления полипропилена при 150 (/), 140 (2), 130 (3) и 120° С (4)
![]()
![]()
На стадии инициирования окисления свободные радикалы могут образоваться также при действии света, излучений высоких энергий, механических напряжений; и тогда процесс инициирования облегчается, так как полимерные радикалы легко реагируют с молекулярным кислородом. Это приводит к образованию дополнительного количества радикалов, развивающих цепь окислительных реакций. Отрыв водорода от молекулярных цепей полимеров может происходить в тех участках их структуры, которые содержат ослабленные С—Н связи (например, СН2-группа в a-положении к двойной связи диеновых эластомеров, третичный водород в полистироле или полипропилене или и др.). При взаимодействии с
кислородом в щелочной среде в макромолекуле целлюлозы образуются карбонильные и карбоксильные группы, что приводит тоже к распаду ее макромолекулы по свободнорадикальному механизму. Эта реакция используется в процессе так называемого предсозревания щелочной целлюлозы и является важной стадией технологического процесса производства вискозного волокна. Некоторые каучуки сшиваются при термоокислительном воздействии, что используется для их вулканизации. Однако в большинстве случаев термоокислительное воздействие приводит к нежелательной деструкции макромолекул полимеров, которая сопровождается резким снижением прочностных свойств полимеров. При окислении полипропилена или полистирола деструкция макромолекул протекает следующим образом:
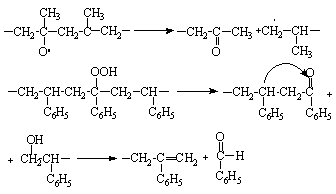
Полиизопрен (натуральный каучук) деструктурируется ввиду диспропорционирования свободных радикалов, образующихся у a-метиленовых групп в процессе его окисления:
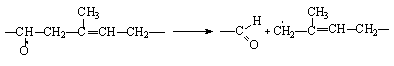
Или
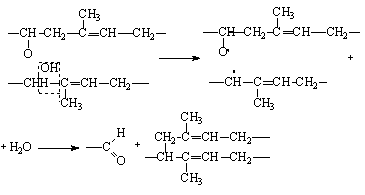
разветвление макромолекулы
Спектроскопические исследования окисленных полимеров показывают, что концентрация гидроперекисных групп в макромолекулах вначале растет, а затем резко падает. Одновременно происходит накопление альдегидных, кетонных, спиртовых, эфирных групп, что хорошо подтверждают рассмотренные выше схемы окисления полимеров (рис. 70).

Рис. 70. Кинетика образования кислородсодержащих функциональных групп в процессе окисления полиизопрена при 80° С:
1 — кетонные ; 2 — гидроксильные; 3—гидроперекисные; 4 — перекисные
Между количеством химически связанного с ненасыщенным полимером кислорода и степенью деструкции полимера наблюдается линейная зависимость (рис.71).
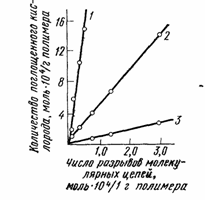
Рис. 71. Зависимость между количеством поглощенного кислорода и степенью деструкции при окислении вулканизатов из натурального каучука при 130 (1), 100 (2) и 75° С (3)
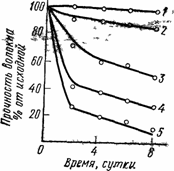
Рис. 72. Зависимость разрывной прочности полиамидного волокна (капрон) от продолжительности нагревания на воздухе при различных температурах: 1 - 80°С; 2 - 100°С; 3 - 120°С; 4 - 140°С; 5 - 160°С

В присутствии кислорода увеличивается скорость дегидрохлорирования поливинилхлорида, так как свободные радикалы облегчают реакцию отрыва атома хлора:
или
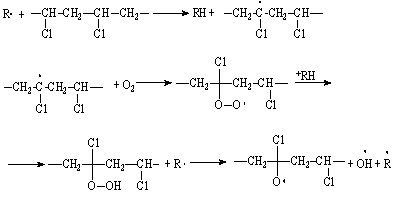
или
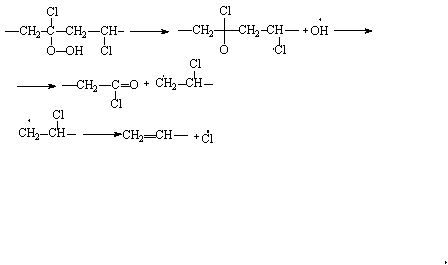
Если термический распад поливинилхлорида начинается с ненасыщенных концевых групп, то при термоокислительном распаде, протекающем то механизму цепного радикального процесса с вырожденным разветвлением, роль концевых групп в реакциях деструкции уменьшается.
В присутствии кислорода сильно ускоряется термическая деструкция полиамидов. Этот процесс сопровождается значительной потерей прочности полиамидного волокна (рис.72).
Процесс окисления полиамидов также является цепной реакцией и начинается у водорода в a-положении к NH-группе:

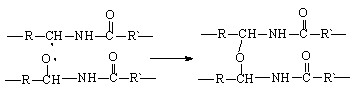
При рекомбинации макрорадикалов могут образоваться поперечные химические связи между макромолекулами:
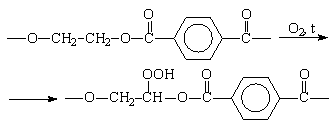
Аналогичным образом протекает термоокислительная деструкция полиэфиров. Процесс термоокислительной деструкции полиэтилентерефталата (лавсана) при температурах 170-220°С протекает через образование окисей и перекисей у метиленовых групп.
После распада гидроперекиси молекула лавсана распадается. Могут образоваться также неустойчивые циклические окиси и перекиси, которые при разрыве образуют карбонильные и карбоксильные группы, ослабляющие эфирную связь и облегчающие ее разрыв.
Наиболее устойчивы при термоокислительной деструкции неорганические и кремнийорганические полимеры, а также фторированные углеводородные полимеры. Сравнительная стойкость полимеров различных классов к термоокислительной деструкции может быть проиллюстрирована данными табл. 9.
Таблица 9.
|
Наименование полимера |
Химическая формула повторяющегося звена |
Потеря веса (% от исх.) за 34 часа при 350°С на воздухе. |
|
Политрифторхлорэтилен |
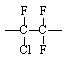 |
98,9 |
|
Полиамид (капрон) |
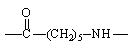 |
94,3 |
|
Эпоксидная смола |
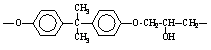 |
93,1 |
|
Полиэтилентерефталат (лавсан) |
|
91,2 |
|
Полиакрилнитрил |
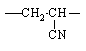 |
72,0 |
|
Фенолформальдегидная смола |
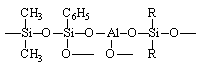 |
68,0 |
|
Полидиметилфенилсилоксан |
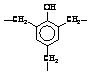 |
22,8 |
|
Полидиметилфенилалюмосилоксан |
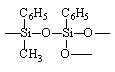 |
8,8 |
|
Политетрафторэтилен (тефлон) |
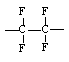 |
2,1 |











