5.1. Коагуляция
В сточных водах могут содержаться твердые (глина, волокна, цемент, кристаллы солей и т.п.) и жидкие (нефть и нефтепродукты, смолы и другие) загрязнения. Коллоидные частицы, представляющие собой совокупность большого числа молекул вещества, содержащегося в сточной воде в диспергированном состоянии, при перемешивании прочно удерживают покрывающий их слой воды. Обладая большой удельной площадью поверхности, коллоидные частицы адсорбируют находящиеся в воде ионы преимущественно одного знака, которые значительно снижают свободную поверхностную энергию коллоидной частицы. Ионы, непосредственно прилегающие к ядру, образуют слой поверхностно-ядерных ионов, или так называемый адсорбционный слой. В этом слое может находиться также небольшое количество противоположно заряженных ионов.
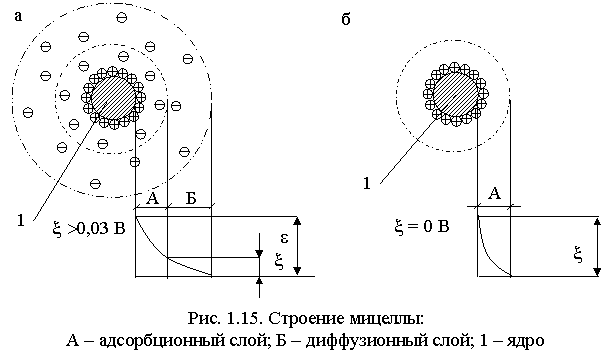
Коагулирующее действие есть результат гидролиза, который происходит вслед за растворением. Силы взаимного притяжения между коллоидными частицами начинают преобладать над электрическими силами отталкивания при ξ – потенциале системы менее 0,03 В. При ξ = 0 В, коагуляция происходит с максимальной интенсивностью, состояние коллоидной системы в этом случае называется изоэлектрическим, а величина рН называется изоэлектрической точкой системы (рис. 1.15.).
Процесс гидролиза коагулянтов и образования хлопьев происходит по следующим стадиям:
Ме3+ + НОН = Ме(ОН)2+ + Н+
Ме(ОН)2+ + НОН = Ме(ОН) 2+ + Н+
Ме(ОН)2+ НОН = Ме(ОН)3 + Н+
В действительности процесс гидролиза значительно сложнее. Ион металла образует ряд промежуточных соединений в результате реакций с гидроксид-ионами и полимеризации. Образующиеся соединения имеют положительный заряд и легко адсорбируются отрицательно заряженными коллоидными частицами. Одним из методов снижения ξ – потенциала коллоидной системы является увеличение концентрации электролитов в сточной воде. Способность электролита вызывать коагуляцию коллоидной системы возрастает с увеличением валентности коагулирующего иона, обладающего зарядом противоположным по знаку заряду коллоидных частиц. Соотношение коагулирующей способности одно-, двух - и трехвалентных ионов приблизительно 1:30:1000, т.е., чем выше валентность, тем более эффективно коагулирующее действие.
При коагуляции хлопья образуются сначала за счет взвешенных частиц и коагулянта или только коагулянта. Образовавшиеся хлопья коагулянта сорбируют вещества, загрязняющие сточные воды, и, осаждаясь вместе с ними, очищают воду.
Основным процессом очистки производственных сточных вод является гетерокоагуляция – взаимодействие коллоидных и мелкодисперсных частице агрегатам и, образующимися при введении в сточную воду коагулянтов. При использовании в качестве коагулянтов солей алюминия и железа в результате реакции гидролиза образуются малорастворимые в воде гидроксиды железа и алюминия, которые сорбируют на раз витой хлопьевидной поверхности взвешенные мелкодисперсные частицы, коллоидные частицы при благоприятных гидродинамических условиях оседают на дно отстойника, образуя осадок:
Al2(SО4)3 + 6Н2О → 2Аl(ОН)3 + 3H2SО4;
FeCl3 + ЗН2О → Fe(OH)3 + 3HCl;
Fe(SO4) + 2H2O → Fe(OH)2 + H2SO4;
4Fe(OH)2 + О2 + 2H2О → 4Fe(OH)3.
Образующуюся в процессе гидролиза серную и соляную кислоты следует нейтрализовать известью или другими щелочами. Нейтрализация образующихся при гидролизе коагулянтов кислот может также протекать за счет щелочного резерва сточной жидкости:
Н+ + HCO – → СО2 + Н2О.
В целях уменьшения расходов коагулянтов процесс коагуляции следует осуществлять в диапазоне оптимальных величин рН. Значения рН при оптимальных условиях коагуляции будут следующими:
- для Аl(ОН)3 рН = 4,57;
- для Fe(OH)2 pH = 8,5-10,5;
- для Fе(ОН)3 рН = 4-6 и 8-10.
Для очистки производственных сточных вод применяют различные коагулянты: соли алюминия, соли железа, соли магния, известь, шламовые отходы и отработанные растворы отдельных производств (например, хлорид алюминия является отходом при производстве этилбензола, сульфат двухвалентного железа – травление металлов, известковый шлам и другие).
Соли алюминия. Сульфат алюминия (глинозем) Al2(SО4)·18Н2О (плотность 1,62 т/м3, насыпная масса на 1 м3 сточных вод равна 1,05-1,1 т, растворимость в воде при температуре 20 °С – 362 г/л). Процесс коагуляции алюминия рекомендуется проводить при значениях рН = 4,5-8. В результате применения сульфата алюминия степень минерализации воды увеличивается. Алюминат натрия NaAlO2, оксихлорид алюминия, полихлорид алюминия [Al2(OH)nCl6n]m(SO4)x, где 1 < n < 5< m < 10, алюмокалиевые [AlK(SO4)2 ·18Н2О] и алюмоаммонийные квасцы [Al(NH4)(SO4)2·12H2O] квасцы имеют меньшую стоимость и дефицитность, чем сульфат алюминия.
Соли железа. Сульфат двухвалентного железа, или железный купорос FeSO4·7H2O (плотность 3 т/м3, насыпная масса на один куб. метр сточных вод равна 1,9 т, растворимость в воде при 20 0С – 265 г/л). Применение процесса коагуляции оптимально при рН > 9. Гидроксид железа – плотные, тяжелые, быстро осаждающиеся хлопья, что является несомненным преимуществом его применения. Хлорид железа FеСl3·6Н2О, сульфат железа Fе2(SO4)3∙9Н2О.
Соли магния – хлорид магния MgCl2·6H2O, сульфат магния MgSO4·7H2O. Соли железа, как коагулянты, имеют ряд преимуществ перед солями алюминия: действие при низких температурах воды; более широкая область оптимальных значений рН среды; большая плотность и гидравлическая крупность хлопьев; возможность использовать для вод с более широким диапазоном солевого состава; способность устранять вредные запахи и привкусы, обусловленные присутствием сероводорода. Однако имеются и недостатки: образование при реакции катионов железа с некоторыми органическими соединениями сильно окрашивающих растворимых комплексов; сильные кислотные свойства, усиливающие коррозию аппаратуры; менее развитая поверхность хлопьев.












