5.5. Ионный обмен
Гетерогенный ионный обмен, или ионообменная сорбция – процесс обмена между ионами, находящимися в растворе, и ионами, присутствующими на поверхности твердой фазы – ионита. При адсорбции электролитов преимущественно адсорбируются ионы одного знака, которые заменяются на эквивалентное количество ионов того же знака. Раствор остается при этом электронейтральным. Он взаимодействует с твердой фазой, обладающей свойствами обменивать ионы, содержащиеся в ней, на другие ионы, содержащиеся в растворе.
Метод ионного обмена применяется для очистки сточных вод предприятий металлургической, химической, коксохимической, машиностроительной и др. отраслей промышленности. Ионный обмен используется в кожевенной, фармацевтической, гидролизной промышленности, а также для удаления солей из сахарных сиропов молока, вин. Иониты широко используются для снижения жесткости воды и её обессоливания, для выделения и разделения разнообразных органических и неорганических ионов. С помощью ионитов улавливают ионы ценных элементов из природных растворов и отработанных сточных вод. Применение этого метода для очистки производственных сточных вод позволяет извлекать и утилизировать ценные примеси (соединения мышьяка, фосфора, а также хром, цинк, свинец, медь, ртуть и др. металлы), ПАВ (поверхностно-активные вещества) и радиоактивные вещества, очищать сточную воду до предельно допустимых концентраций с последующим ее использованием в технологических процессах или системах оборотного водоснабжения. Ионный обмен делает возможным промышленное производство многих продуктов жизнедеятельности микроорганизмов (антибиотиков, аминокислот).
По знаку заряда обменивающихся ионов иониты делят на катиониты и аниониты, проявляющие соответственно кислотные и основные свойства. Катиониты извлекают из растворов электролитов положительные ионы, аниониты – отрицательные. Если иониты обменивают и катионы, и анионы, их называют амфотерными. В качестве ионитов могут использоваться неорганические и органические материалы, способные к обмену ионов и практически нерастворимые в воде. Иониты подразделяются на природные и искусственные, или синтетические. Синтетические ионообменные материалы выпускаются в виде зернистых порошков, волокон и мембран. Мелкозернистые порошки имеют размер частиц 0,04-0,07 мм, крупнозернистые – 0,3-2,0 мм. Последние предназначены для работы в фильтрах со слоями значительной высоты 1-3 м, а порошкообразные мелкозернистые – со слоями высотой 3-10 мм. Размер частиц ионита влияет на перепад давления в фильтрах. С уменьшением размера частиц перепад давления в слое увеличивается. Следовательно, измельчение ионитов в процессе очистки нежелательно. Это приводит не только к росту сопротивления фильтра, но и к неравномерному распределению скоростей потока сточной воды по сечению фильтра. В результате столкновения зерен ионита друг с другом и о стенки аппаратуры происходит их истирание. Механически прочными принято считать иониты, степень истираемости которых не превышает 0,5 %.
К неорганическим природным ионитам относят цеолиты, глинистые минералы, полевые шпаты, различные слюды. Катионообменные свойства обусловлены содержанием алюмосиликатов типа Nа2-Al2O3-nSiO2-mH2O. Ионообменными свойствами обладает также фторопатит [Ca5(PO4)]F и сидопатит [Са5(РО4)]ОН. К неорганическим синтетическим ионитам относят силикагели, пермутиты, трудно растворимые оксиды и гидроксиды некоторых металлов (например, алюминия, хрома циркония). Катионообменные свойства, например, силикагеля, обусловлены обменом ионов водорода гидроксидных групп на катионы металла, проявляющиеся в щелочной среде. Катионообменные свойства присущи и пермутитам, получаемым сплавлением соединений, содержащих алюминий и кремний.
Органические природные иониты – это гуминовые кислоты почв и углей. Они проявляют слабокислотные свойства. Для усиления кислотных свойств и обменной емкости угли измельчают и сульфируют в избытке олеума. Сульфоугли являются дешевыми полиэлектролитами, содержащими сильно - и слабокислотные группы. К недостаткам таких электролитов следует отнести их малую химическую стойкость и механическую прочность зерен, а также небольшую обменную емкость, особенно в нейтральных средах. К органическим искусственным ионитам относят ионообменные смолы с развитой поверхностью. Синтетические ионообменные смолы представляют собой высокомолекулярные соединения, углеводородные радикалы которых образуют пространственную сетку с фиксированными на ней ионообменными функциональными группами.
Практическое значение имеют неорганические природные, искусственные алюмосиликаты, гидроокиси и соли многовалентных металлов; применяются также иониты, полученные химической обработкой угля, целлюлозы и лигнина.
Однако ведущая роль принадлежит синтетическим органическим ионитам – ионообменным смолам. Иониты получают методом сополимеризации и сополиконденсации с последующим сшиванием образующих цепей. В конденсационных ионитах сшивание осуществляется за счет метиленовых (-СН2-) или метиновых (=СН-) мостиков, а также азотсодержащих группировок. В полимеризационных – чаще при помощи n-дивинилбензола и его изомеров. Число таких поперечных связей определяет размер ячеек сетки и жесткость матрицы, представляющей собой пространственную углеводородную сетку – трехмерный каркас. В каркас включены несущие заряд группы атомов, называемые фиксированными ионами или анкерными. Они являются потенциалопределяющими. Ионы противоположного знака называются противоионами, они и являются обменными. Противоионы связаны с потенциалопределяющими ионами каркаса электростатическими силами, а потому способны к обмену на другие ионы. При сокращенном написании ионита матрицу обозначают в общем виде R, а активную группу указывают полностью. Например, сульфокатионит запишется как RSO3H, где R – матрица, Н – противоион, SО3 – анкерный ион. К веществам, обладающим ионообменными свойствами, принадлежат некоторые марки стекол. Структуру стекла составляет трехмерная сетка кремнекислородных (силикатных) ионов. В пустотах этой трехмерной решетки находятся катионы щелочных или щелочноземельных металлов, удерживаемые электростатическими силами и способные к обмену на другие катионы (в частности, на катионы водорода).
Срок службы синтетических катионитов больше, чем анионитов. Это объясняется низкой стабильностью групп, которые в анионитах выполняют роль фиксированных ионов.
Различают следующие виды ионитов:
- Сильнокислотные катиониты, содержащие сульфогруппы (SO3H) и фосфорные группы [РО(ОН)2], и сильноосновные анионы, содержащие четвертичные аммониевые основания (R3NOH).
- Слабокислотные катиониты, содержащие карбоксильные (СООН) и фенольные группы (С6Н5ОН), диссоциирующие при рН > 7, а также слабоосновные аниониты, содержащие первичные (- NH2) и вторичные (=NH) аминогруппы, диссоциирующие при рН > 7.
- Иониты смешанного типа, проявляющие свойства смеси сильных и слабых кислот или оснований.
Катиониты в качестве противоионов могут содержать ионы металлов вместо ионов водорода, т.е. находиться в солевой форме. Точно так же и аниониты могут находиться в солевой форме, если в качестве противоионов содержат ионы тех или иных кислот вместо ионов гидроксида.
Реакция ионного обмена протекает следующим образом:
- при контакте с катионитом RSO3H + NaCl ↔ RSO3 + НСl;
- при контакте с анионитом RSO3H + NaCl ↔ RSO3 + НСl.
Ионный обмен происходит в эквивалентных соотношениях и в большинстве случаев является обратимым. Реакция ионного обмена протекает вследствие разности химических потенциалов обменивающихся ионов. В общем виде эти реакции можно записать в виде
mA+bRmB ↔ mRA + B (1.16)
Реакция идет до установления ионообменного равновесия. Скорость установления равновесия зависит от внешних и внутренних факторов:
- гидродинамического режима жидкости;
- концентрации обменивающихся ионов;
- структуры зерен ионита;
- проницаемости ионита для ионов.
Функциональную зависимость состава противоионов ионита внешнего раствора при постоянных температуре и давлении называют изотермой ионного обмена. Графически изотерма изображается в безразмерных координатах a-a
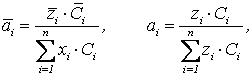
где ![]() – эквивалентные доли i-го иона соответственно в фазе ионита и в растворе;
– эквивалентные доли i-го иона соответственно в фазе ионита и в растворе;
![]() – концентрации i-гo иона в ионите и растворе в условиях равновесия системы, моль ионов на один грамм ионита; zi: – заряд i-гo иона.
– концентрации i-гo иона в ионите и растворе в условиях равновесия системы, моль ионов на один грамм ионита; zi: – заряд i-гo иона.
Величины ![]() , и
, и ![]() , изменяются в интервале от 0 до 1, изотерма изображается в квадрате со стороной равной 1. Отношение
, изменяются в интервале от 0 до 1, изотерма изображается в квадрате со стороной равной 1. Отношение ![]() , называют коэффициент распределения i-гo иона при ионообменной сорбции. Этот коэффициент является мерой обогащения или обеднения ионита данным веществом. Кр < 1 – ионит обеднен, Кр >1 – ионит обогащен i-ым компонентом по сравнению с равновесным раствором.
, называют коэффициент распределения i-гo иона при ионообменной сорбции. Этот коэффициент является мерой обогащения или обеднения ионита данным веществом. Кр < 1 – ионит обеднен, Кр >1 – ионит обогащен i-ым компонентом по сравнению с равновесным раствором.
Если в растворе содержится не один а несколько компонентов, то селективность ионита оценивается по избирательности К равной соотношению коэффициентов распределения конкурирующих ионов. Например, для двух ионов А и В

где КА,В > 1 – ионит селективен к одному иону А, при КА,В < 1 – избирательно сорбируется ион В, при КА,В = 1 – ионит не проявляет селективности ни к одному из ионов.
Если обменная реакция описывается в общем виде уравнением (1.16), то равновесие ионообменных процессов можно выразить следующей формулой

где КА,В – константа равновесия; ![]() – концентрация ионов в твердой фазе; С – концентрация ионов в жидкой фазе; Х – безразмерная концентрация в жидкой фазе
– концентрация ионов в твердой фазе; С – концентрация ионов в жидкой фазе; Х – безразмерная концентрация в жидкой фазе
ХA=СА / С0, ХB = СB / С0,
Y – безразмерная концентрация в твердой фазе:
YА = СА / и, YB=СB / и,
где и – обменная емкость ионита; С0 – общая "эквивалентная" концентрация ионов жидкости.
Иониты, содержащие одинаковые активные группы, называются монофункциональными, а иониты, которые содержат функциональные группы различной химической природы – полифункциональными. Полифункциональные иониты обладают смешанными сильно - и слабоосновными свойствами.
Важнейшим свойством ионитов является их поглотительная способность, так называемая обменная емкость. Максимальное количество ионов, которое поглощается обменным путем одним граммом ионита, есть емкость поглощения, или обменная емкость. Различают полную, статическую и динамическую обменные емкости. Полная емкость ионита – количество находящихся в сточных водах грамм-эквивалентов ионов, которое может поглотить 1 м3 ионита до полного насыщения. Статическая емкость – это обменная емкость ионита при равновесии в данных рабочих условиях. Статическая обменная емкость обычно меньше полной. Динамическая обменная емкость – это емкость ионита до проскока ионов в фильтрат. Динамическая емкость меньше статической. Рабочая емкость ионита оценивается по количеству находящихся в воде грамм-эквивалентов ионов, которое может поглотить 1м ионита до начала проскока в фильтрат поглощаемых ионов. Ионообменное равновесие определяется природой ионита, гидратацией обменивающихся ионов, их концентрацией в фазе ионита и растворе. Обмен разновалентных ионов зависит также и от величины их заряда.
Если катиониты находятся в Н - или Na-форме, обмен катионов будет проходить по реакциям
Ме++Н[К] ↔ Ме[К]+Н+,
Ме+ + Na[K] ↔ Me[K] + Na+,
где Ме+ – катион, находящийся в сточной воде; [К] – сложный комплекс катионита.
Величина рН сточной воды, при которой происходит обмен ионами, зависит от константы диссоциации ионообменных групп. Сильнокислотные катиониты позволяют осуществлять процесс ионного обмена при любых значениях рН, а слабокислотные – в щелочных и нейтральных, при рН > 7. Так катиониты с карбоксильными группами обмениваются ионами при рН > 7, а с фенольными – при рН > 8.
Иониты в контакте с водой не растворяются, но поглощают некоторое количество воды, являясь гелями с ограниченной набухаемостью. При соприкосновении с водой, вследствие осмотических явлений, происходит их набухание; размер пор увеличивается от 0,5-1,0 нм до 4,0 нм. Объем ионитов обычно увеличивается в 1, 2-3 раза. Степень набухания зависит от строения ионита, природы противоионов, от состава раствора. Набухание влияет на скорость и полноту обмена ионов, а также на селективность ионита. Оно прекращается после того, как разность осмотических давлений до и после обмена уравновесится упругими силами растяжения и сжатия ионита. Сильно набухающие смолы, называемые гелеобразными, имеют удельную обменную поверхность 0,1-0,2 м2/г. Макропористые иониты обладают развитой обменной поверхностью, равной 60-80 м2/г. Синтетические иониты набухают больше и имеют большую обменную емкость, чем природные.
На кинетику ионного обмена влияют также температура, концентрация ионов и др. Иониты должны обладать термической и химической стойкостью. При нагревании ионитов в воде и на воздухе возможно разрушение их зерен, отщепление активных групп, что приводит к снижению емкости. Для каждого ионита имеется температурный предел, выше которого его нельзя использовать. В общем случае термическая устойчивость анионитов ниже, чем катионитов. Химическая стойкость оценивается по изменению полной обменной емкости и изменению массы ионита.
Характерной особенностью ионного обмена является его обратимость, т.е. возможность проведения реакции в обратном направлении, что и лежит в основе регенерации ионитов.
Регенерация отработанных катионитов осуществляется 2-8 % растворами кислот (при Н-катионите) или раствором хлористого натрия (при Na-катионите). Регенерационные растворы – элюаты – содержат катионы. После взрыхления и промывки катиониты заряжаются
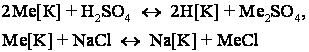
Поскольку в сточных водах, как правило, содержится несколько катионов, большое значение имеет селективность их поглощения, которая зависит от степени набухания в порах и размера пор ионита. При малом размере пор большие ионы не могут достичь внутренних активных групп. В целях повышения селективности ионитов к определенным металлам в его состав вводят вещества, способные образовывать с ионами этих металлов внутрикомплексные соединения – хилаты.
Для каждого вида катионита установлены ряды катионов по энергии их вытеснения. Например, для сильнокислого сульфокатионита КУ-2: Н+ < Na+ < NH4+ < Mg2+ < Zn2+ < Co2+ < Cu2+ < Cd2+ < Ni2+ < Ca2+ < Sr2+ < Pb2+ < Ba2+, для слабокислого катионита КБ-4: Mg2+ < Са2+ < Ni2+ < Со2+ < Cu2+.
Слабоосновные аниониты поглощают анионы сильных кислот
![]()
, где [А] – сложный органический комплекс анионита.
Для большинства анионов справедлив следующий ряд по поглощающей способности SO42 - > NO3 - > Сl-.
Регенерация отработанных слабоосновных анионитов достигается фильтрованием через слой анионита 2-6 % водных растворов щелочей (например NaOH Na2CO3 или NH4OH). Аниониты при этом переходят в ОН-форму
![]() .
.
Элюаты содержат в сконцентрированном виде все извлеченные из сточных вод анионы. При необходимости регенерируемый анионит можно перевести в С1 – форму, пропуская раствор NaCl. В отработанном заряжающем растворе накапливается едкий натрий.
Элюаты представляющие собой отработанные растворы кислот и щелочей, нейтрализуют или обрабатывают с целью рекуперации ценных продуктов. Нейтрализацию проводят смешением кислых и щелочных элюатов, а также дополнительным введением кислоты или щелочи. Степень регенерации в процентах определяют по формуле
![]() (1.17)
(1.17)
где ив – восстановленная обменная емкость; ип – полная обменная емкость.
На степень регенерации влияют: тип ионита, состав насыщенного слоя, природа концентрация и расход регенерирующего вещества, температура, время контакта и расход реагентов. Процесс регенерации ионитов состоит из трех стадий: взрыхления ионита, регенерации, отмывки ионита от продуктов регенерации и избытка регенерирующего вещества. Объем промывных вод обычно составляет 75-100 % объема регенерационных растворов.
Процессы ионообменной очистки сточных вод осуществляются в установках, периодического или непрерывного действия. Установка периодического действия состоит из фильтра (или колонны) периодического действия, насоса, емкостей и контрольно-измерительных приборов. Фильтр периодического действия представляет собой закрытый цилиндрический резервуар с расположенным у днища щелевым дренажным устройством, обеспечивающим равномерное отведение воды по всему сечению фильтра, высота слоя загрузки ионита 1,5-2,5 м.
Фильтр может работать по параллельно-точной схеме (при подаче сточной воды и регенерирующего раствора сверху) и по противоточной схеме (сточная вода подается снизу, а регенерирующий раствор – сверху). На продолжительность фильтроцикла большое влияние оказывает содержание взвешенных веществ поэтому перед подачей воды в ионообменную установку следует обеспечить максимальное их удаление. При фильтровании сточной воды через неподвижный слой ионита со скоростью до 10 м/ч расчет фильтра производится на основании материального баланса. При очистке сточных вод, загрязненных взвешенными веществами, применяют ионообменные колонны с псевдоожиженным слоем ионита.
На рис. 1.39, а – в приведены схемы установок периодического действия с одним ионообменным аппаратом. Все приведенные схемы отличаются способом регенерации ионита. На схеме с проточной регенерацией (см. рис. 1.39, а) регенерирующий раствор готовят непрерывно при подаче в эжектор воды и концентрированного раствора кислоты или щелочи. Подачу кислоты прекращают после пропускания через ионит заданного объема регенерационного раствора. А подачу воды продолжают для отмывки ионита от регенерационного раствора. Элюат и промывные воды после нейтрализации можно сбрасывать в канализацию.
По схеме с оборотом части реагента (см. рис. 1.39, б) регенерирующий раствор готовится в специальной емкости 3. Этим достигается сокращение расхода регенерирующего реагента и объема регенератора, т.к.к регенерирующий раствор готовят путем добавления к первой порции промывочной воды концентрированного реагента. В результате часть реагента находится в обороте.

По схеме с фракционированием реагента (см. рис. 1.39, в) достигается наименьший расход реагентов. Регенерат разделяют на отдельные фракции и собирают в емкости. Первую фракцию, более концентрированную, направляют на переработку. Промывную воду также собирают в две емкости. При следующей регенерации в качестве первой фракции используют вторую фракцию от предыдущей регенерации, доведенную до заданной концентрации реагентом.
Схема с плавающим фильтром (см. рис.1.39, г) дает возможность получить более концентрированные регенераты. Очищаемую воду последовательно пропускают через два фильтра. В начале проскока во втором фильтре подключают отрегенерированный третий фильтр, а первый по ходу воды выводится на регенерацию. Регенерация отработанного фильтра может производиться по описанным выше схемам с одним аппаратом.
Недостатки установок периодического действия: большие объемы аппаратов; значительный расход реагента; большая единовременная загрузка ионита; сложность автоматизации процесса – ограничивают возможность их применения на практике.
В качестве примера приведена технологическая схема ионообменной очистки сточных вод производства хлоранилина от смесей анилина с хлоранилином (рис. 1.40). Необработанная сточная вода по линии I поступает в резервуар 1, куда дозируется из мерников 2 соляная кислота для снижения рН < 4-4,5. Подкисленная сточная вода насосом 16 подается на фильтр 3, где отделяется от выпавших при подкислении взвешенных веществ. Фильтрат поступает в блок последовательно расположенных ионообменных колонн 7 с общей высотой слоя катионита КУ-2 не менее 3 м; скорость фильтрования около 2 м3/ч на 1 м2 площади поперечного сечения ионообменной колонны.
Обычно две колонны работают в режиме ионного обмена, а одна регенерируется. Регенерационный аммиачно-метанольный раствор насосом 15 из мерника 8 подается в регенерируемую колонну снизу вверх. Подогретая до 35-40 0С вода для промывки отрегенерированной колонны поступает в нее через тот же мерник 8. Из колонны отработанный регенерационный раствор выпускается в приемник 12, откуда центробежным насосом 11 подается в ректификационную колонну 9 для отгонки метанола и аммиака.
Кубовый осадок из этой колонны направляется в отстойник, где происходит разделение фаз: водный слой направляется в сборник, а слой сырых аминов на разгонку и утилизацию. Разделение фаз происходит простым отстаиванием, и эта операция требует много времени.
После регенерации водно-метанольным раствором аммиака катионит для перевода в водородную форму промывают 8-10 % раствором соляной кислоты, поступающем из емкости 4. Кислота, вытекающая из колонны, собирается в емкость 13 и насосом 14 подается в мерники 2 для регенерирования рН сточной воды. Туда направляются промывные воды. Обработанная сточная вода имеет слабокислую реакцию и должна перед сбором нейтрализоваться известковым раствором.
Процесс ионного обмена может быть представлен в виде нескольких стадий:
- перенос ионов А из ядра потока жидкости к внешней поверхности пограничной жидкой пленки, окружающей зерно ионита; диффузия ионов через пограничный слой;
- переход ионов через границу раздела фаз в зерно ионита;
- диффузия ионов А внутри зерна ионита к ионообменным функциональным группам;
- собственно химическая реакция двойного обмена ионов А и В;
- диффузия ионов В внутри зерна ионита к границе раздела фаз;
- переход ионов В через границу раздела фаз на внутреннюю поверхность пленки жидкости;
- диффузия ионов В через пленку;
- диффузия ионов В в ядро потока жидкости.
Химическая реакция ионного обмена происходит быстро и не определяет суммарную скорость процесса. А диффузия в пленке жидкости и диффузия в зерне ионита протекают медленно. Они и определяют скорость ионного обмена. Для того чтобы оценить зависимость скорости реакции от концентрации вещества, введем понятие числа био:
Bi = β·r0 / (Kr·D), (1.18)
где β – коэффициент массоотдачи; r0 – радиус зерна иона; Кr – константа Генри; D – коэффициент массопроводности.
При Bi < 1 (концентрация вещества в сточных водах менее 0,003 моль/л) – скорость обмена определяется диффузией ионов через пленку жидкости – пленочная кинетика). При Bi < l (концентрация вещества не менее 0,1моль/л) – скорость процесса определяется диффузией ионов внутри зерна – гелевая кинетика. Если концентрация раствора находится в пределах 0,003-0,1моль/л – скорость ионного обмена определяют оба вида диффузии. Коэффициенты диффузии различных ионов в смоле имеют порядок 10–6-10–9 см2/с, а в воде 10–4-10–5 см2/с. Коэффициент диффузии снижается при увеличении размера гидратированных ионов в растворе и росте заряда обменивающихся противоионов. Для внешнедиффузионной области при значениях числа Рейнольдса Rеэ=2-30 для расчета коэффициента массоотдачи может быть использована следующая формула:
Nuэ= 0,725 .Reэ 0,47··PrD1/3, (1.19)
где Reэ = u·dэ / ν – число Рейнольдса; Nuэ = β dэ / D – число Нуссельта; PrD = ν/D – число Прандтля.
Для определения основных параметров установки подсчитывает суммарную оптимальную площадь сечения ионообменных колонн, по расходу сточных вод и скорости фильтрования через псевдоожиженный слой ионита:
![]()
где ![]() – скорость фильтрования на 1 м: поперечного сечения колонны, м3/ч; Q –расход сточной воды, м3/ч.
– скорость фильтрования на 1 м: поперечного сечения колонны, м3/ч; Q –расход сточной воды, м3/ч.
Общее количество ионов, которое должно быть задержано в ионообменной колонне за 1 ч, зависит от их начальной Сн и конечной Ск концентраций и составляет Q·(Cн – Ск). Для поглощения этого количества ионов необходимо подать определенное количество воздушно-сухого ионита с динамической емкостью Ед
Мч = Q·(Cн – Ск) / Ед, (1.20)
где, Мч – требуемая масса воздушно-сухого ионита, т/ч.
Если продолжительность рабочего цикла ионообменных колонн между двумя регенерациями равно t ч, то общая их загрузка
Мо6щ=Мч·t. (1.21)
Объем загрузки ионообменных колонн до образования псевдоожиженного слоя
W1 = Moбщ / dн, (1.22)
где dн – насыпная плотность ионита, т/м3.
Поскольку суммарная площадь ионообменных колонн определяется оптимальной скоростью фильтрования, то высота набухшего слоя ионита до псевдоожижения составит:
H1 = W1 / Soбщ. (1.23)
Т.к.к оптимальное отношение высоты псевдоожиженного слоя к высоте q неподвижного слоя Н2 / Н1 = 1,5, то
Н2 = 1,5 W1 / Soбщ (1.24)
Если задаться диаметром ионообменной колонны Dк, то число колонн
![]()
Далее подсчитывают объем регенерационных растворов и емкостей для них.
Непрерывный ионообмен дает возможность снизить затраты ионита, реагентов для регенерации, промывочной воды, а также применять более компактное оборудование по сравнению с периодическими ионообменниками. Колонны непрерывного действия могут работать как с движущимся слоем ионита (в качестве которого и обычно используются синтетические ионообменные смолы), так и кипящим. Установки непрерывного действия обычно содержат несколько ионообменных аппаратов с катионитом и анионитом.
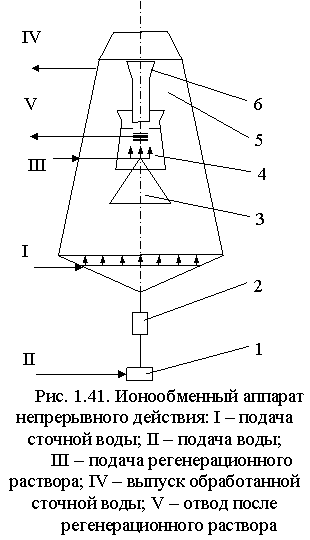
В аппаратах непрерывного действия (рис. 1.41) ионит движется по замкнутому контуру, последовательно проходя стадии сорбции, регенерации и промывки.
Аппарат состоит из ионообменной емкости, выполненной в виде усеченного конуса 9. Внутри этого конуса находится второй усеченный конус 7, где происходят процессы регенерации и отмывки. Сточная вода подается по линии I в колонну через трубку с коническими насадками. Пройдя через псевдоожиженный слой ионита, обработанная вода выходит из верхней части колонны (линия IV). Обработанный ионит осаждается в нижней части колонны. Во внутреннем полом усеченном конусе 7 скорость движения потока воды уменьшает с помощью регулятора 5, что способствует вовлечению отработанного ионита в этот конус и последующему осаждению его в нижней части ионообменной колоны. Регенерационный раствор подается в нижнюю часть внутреннего усеченного конуса по линии III, а отводится в верхней части (линия V). Регенерированный ионит, продолжая опускаться навстречу восходящему потоку воды, промывается и переходит в рабочую зону колонны. Аппарат прост в конструктивном исполнении и эффективен в работе.
Ионообменный аппарат должен удовлетворять следующим требованиям:
- иметь необходимый рабочий объем;
- обеспечивать гидродинамический режим движения взаимодействующих фаз;
- обеспечивать требуемый уровень насыщения ионита;
- обеспечивать небольшое гидравлическое сопротивление;
- минимизировать капитальные и эксплуатационные затраты
Таким образом, систематизируя сказанное выше, аппараты ионного обмена можно классифицировать по различным признакам.
- По организации процесса – аппараты непрерывного действия, периодического и полунепрерывного.
- По гидродинамическому режиму – аппараты вытеснения, аппараты смешения и аппараты промежуточного типа.
- По состоянию слоя ионита – с неподвижным слоем, с движущимся слоем, пульсирующим, перемешиваемым и циркулирующим.
- По организации контакта взаимодействующих фаз – с непрерывным контактом и со ступенчатым контактом.
- По организации взаимного направления движения фаз – прямоточные, противоточные и со смешанным током.
- По конструкции – на колонные и емкостные.
- По способу подвода энергии – без подвода энергии извне (с гравитационным движением твердой фазы) и с подводом энергии извне (принудительное движение твердой фазы).












