Окисление «активным» хлором
Обезвреживание сточных вод хлором или его соединениями – один из самых распространенных способов очистки от ядовитых цианинов, а также от таких органических и неорганических соединений, как сероводород, гидросульфит, сульфид, метилмеркаптан и др.
Сточные воды, содержащие ядовитые цианиды, образуются на машиностроительных и металлообрабатывающих заводах в гальванических цехах. Значительное количество цианидсодержащих сточных вод получается при промывке изделий после закалки их в расплавах цианидов. Обычно содержание цианидов в таких сточных водах колеблется от 20 до 100 мг/л, но бывает и выше.
Окисление ядовитых цианид-ионов CN– осуществляется путем перевода их в нетоксичные цианаты СNO–, которые затем гидролизуются с преобразованием ионов аммония и карбонатов:
СN– + 2ОН– – 2е → CNO– + НО;
CNO– + 2Н2О→ NH4+ + СО32–.
Возможен также перевод токсичных соединений в нетоксичный комплекс или в осадок (в виде нерастворимых цианидов) с последующим удалением его из сточных вод отстаиванием или фильтрованием.
Хлор и вещества, содержащие «активный» хлор, являются наиболее распространенными окислителями. Их используют для очистки сточных вод от сероводорода, гидросульфида, метилсернистых соединений, фенолов, цианидов и др.
При введении в воду хлор гидролизуется, образуя хлорноватистую и соляную кислоты:
![]()
В сильнокислой среде равновесие этой реакции сдвинуто влево, в воде присутствует молекулярный хлор; при значениях рН > 4 молекулярный хлор в воде практически отсутствует.
Образовавшаяся в растворе гидролиза хлора хлорноватистая кислота диссоциирует на ион гипохлорита ОСl– и ион водорода Н+.
Степень диссоциации хлорноватистой кислоты которой зависит от рН среды. При рН = 4 молекулярный хлор практически отсутствует:
![]()
Сумма Сl2 + НОСl + ОСl– и называется свободным «активным» хлором.
В присутствии аммонийных соединений в воде образуется хлорноватистая кислота, хлорамин NH2Cl и дихлорамин NHCl2. Хлор в виде хлорамина называется связанным «активным» хлором.
Источниками «активного» хлора могут быть также хлорат кальция, гипохлориды, хлораты, диоксид хлора. Хлорат кальция (хлорную известь) получают при взаимодействии Са(ОН) 2+Сl2
= СаОСl2+Н2О.
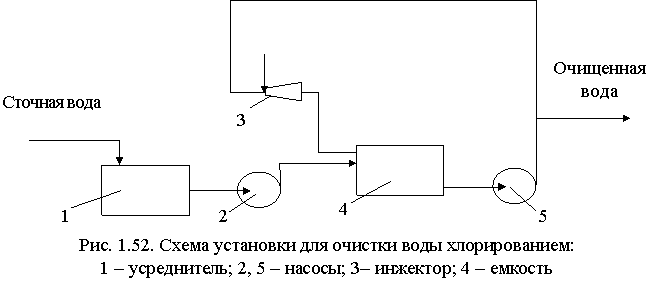
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных. Принципиальная схема очистки вод хлорированием показана на рис. 1.52. Хлорирование проводится в емкости, включенной в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования.
SHAPE \* MERGEFORMAT
При обезвреживании вод от цианидов процесс проводят в щелочной среде (рН = 9). Цианиды можно окислить до элементного азота и диоксида углерода по уравнениям
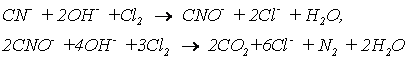
При снижении рН возможно протекание реакции прямого хлорирования цианида с образованием токсичного хлорциана.
![]()
Более надежным и экономически целесообразным методом является окисление цианидов гипохлоритами в щелочной среде (рН = 10-11). В качестве реагента, содержащего ион гипохлорита ОСl– , служат хлорная известь, гипохлориты кальция или натрия. При окислении цианидов «активным» хлором процесс можно проводить в одну ступень до получения цианатов:
![]() (1)
(1)
Реакция протекает быстро (1-3 мин.) и полно. Окисление цианидов до цианатов происходит за счет атомного кислорода в момент его выделения из окислителя. Образующиеся цианаты CNO– легко гидролизуются до карбонатов:
![]()
Скорость гидролиза зависит от рН среды. При рН = 5,3 за сутки гидролизуется около 80 % цианатов. В двухступенчатом процессе цианиды окисляются до N2 и СО2. На первой ступени процесс протекает по уравнению реакции (1) окисления до получения цианатов. На второй ступени вводят дополнительное количество окислителя, и реакция протекает по уравнению
![]()
В растворах содержащих цианидионы и медь, одновременно могут присутствовать комплексные цианиды меди
![]() и
и ![]()
, окисление которых гипохлоритом проходит по уравнениям

При окислении ядовитого комплекса цианида цинка происходит следующая реакция:
![]()
Для определения расходов гипохлоритов кальция или натрия, а также хлорной извести на окисление цианидсодержащих сточных вод можно воспользоваться формулой:
![]()
где X – требуемое количество реагента, кг/сутки; k – коэффициент запаса реагента, принимаемый равным 1,2-1,3; Q – количество цианидсодержащих сточных вод, м3/сутки; а – содержание активного хлора в реагенте, равной в товарной хлорной извести 30-35 %, в гипохлорите кальция 30-45 %; x1 – теоретическое количество активного хлора, необходимого для окисления цианидов, г/м3:
![]()
где n – стехиометрический коэффициент (по активному хлору); С – концентрация цианидов в сточных водах (в пересчете на цианидион), г/м3.
Для определения коэффициента и подсчитывается количество активного хлора в гипохлорите. Активный хлор определяется по количеству грамм-атомов йода, выделенных данным реагентом из йодистого калия в кислой среде. Запишем реакцию окисления простых цианидов гипохлоритом в ионно-электронном виде

Это значит, что при взаимодействии гипохлорита с КI (калий йодистый) наблюдались следующие реакции
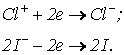
Выделившиеся два грамм-атома йода соответствуют двум грамм-атомам активного хлора. Таким образом, соотношение масс реагирующих цианид-иона и «активного хлора» гипохлорита образом, гипохлорита равно 26:71, следовательно, на одну часть цианид-иона требуется 2,73 части активного хлора, т.е. n = 2,73.
Величина коэффициента n определяется для каждой реакции окисления цианидсодержащих соединений. Так при окислении комплексных цианидов меди
![]() и
и ![]()
величина n равна соответственно 3,18 и 2,96, а для окисления комплексных цианидов цинка n = 2,73. При окислении цианидсодержащих сточных вод ионом гипохлорита окислитель может расходоваться не только на окисление цианидов, но и на окисление других веществ, присутствующих в сточных водах. Поэтому значение n следует проверять экспериментально для конкретных сточных вод.
При наличии в сточной воде аммиака, аммониевых солей или органических веществ, содержащих аминогруппы, хлор, хлорноватистая кислота и гипохлориты вступают с ними в реакцию, образуя моно - и дихлорамины, а также трихлористый азот

При обезвреживании сточных вод обычно применяется 5 % рабочий раствор реагента (по «активному» хлору).
Обработка цианидсодержащих сточных вод диоксидом хлора СlО2 имеет ряд преимуществ:
- высокая окислительная способность СlО2 по сравнению с другими окислителями (кроме фтора и озона);
- водные растворы СlО2 устойчивы в течение длительного времени;
- при обработке сточных вод диоксидом хлора не образуется высокотоксичных продуктов прямого хлорирования (хлорциана, хлорфенола и др.) в любом диапазоне величие рН.
Окисление цианида диоксидом хлора протекает по уравнению
![]()
Более эффективно процесс окисления идет при рН![]() 10.
10.
При начальном содержании цианидов 25 мг/л и продолжительности окисления 1 мин – эффективность составляет 95 %, а через 10 мин реакция окисления практически заканчивается.
Хлорирование применяется для дезодорации сточных вод, образующихся при варке сульфатной целлюлозы и при выпаривании тарного щелока на целлюлозно-бумажных комбинатах. Эти сточные воды содержат сероводород, сульфиды, метил-меркаптан и др.
В щелочной среде хлор окисляет сульфиды до сульфатов:
![]()
В кислой и нейтральной среде возможно образование сульфитов:
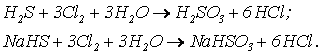
При избытке хлора окисление всегда идет до сульфатов. Метилмеркаптан окисляется хлором несколько медленнее, чем сероводородом, но значительно быстрее, чем сульфиды и дисульфиды. В зависимости от расхода хлора окисление метилмеркаптана может протекать с образованием различных продуктов:

Поскольку метилмеркаптан окисляется хлором сравнительно быстро, продолжительность контакта сточных вод выпарной станции (загрязненных в основном сероводородом и метилмеркаптаном) с хлором составляет 5 мин.
В зависимости от агрегатного состояния вводимых в воду хлора или хлорсодержащих реагентов определяется технология обработки сточных вод. Если эту воду обрабатывают газообразным хлором или диоксидом хлора, то процесс окисления осуществляется в абсорберах; если хлор или диоксид хлора находятся в растворе, то их подают в смеситель и далее в контрольный резервуар, в них обеспечивается эффективнее их смешивание и требуемая продолжительность контакта со сточной водой.
Гипохлорит (оксохлорат) натрия образуется при пропускании газообразного хлора через раствор щелочи:
![]()
Гипохлорит кальция приготовляют хлорированием гидроксида кальция при температуре 25-30 °С:
![]()
Промышленность выпускает двухосновную соль
![]()
Сильным окислителем является хлорат натрия NaClO2, который разлагается с выделением ClO2. Диоксид хлора ядовитый зеленовато-желтый газ, обладающий более интенсивным запахом, чем хлор. Для его получения проводят следующие реакции:

Во время реакций рН поддерживают в пределах 8-11. Контроль полноты окисления производят по остаточному «активному» хлору, концентрация которого должна быть не менее 5-10 мг/л.












