3.2. Термодинамика процесса химической коррозии
В качестве примера рассмотрим процесс окисления металла в атмосфере кислорода. Процесс окисления металла может быть представлен реакцией вида:
![]() . (3.2)
. (3.2)
Возможность протекания такой реакции определяется соответствующим изменением энергии Гиббса:
![]() , (3.3)
, (3.3)
где К − константа равновесия химической реакции; ![]() − алгебраическая сумма логарифмов начальных активностей веществ - продуктов химической реакции.
− алгебраическая сумма логарифмов начальных активностей веществ - продуктов химической реакции.
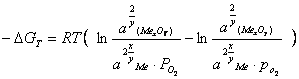 . (3.4)
. (3.4)
Если металл и оксид металла − чистые вещества, то
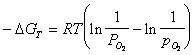 , (3.5)
, (3.5)
где ![]()
![]() − равновесное давление кислорода в системе;
− равновесное давление кислорода в системе; ![]() - начальное давление кислорода в газовой фазе.
- начальное давление кислорода в газовой фазе.
Окончательно:
![]() . (3.6)
. (3.6)
Таким образом, процесс окисления металлов термодинамически вероятен, если ![]() >
> ![]() (
(![]() < 0) и невозможен, если
< 0) и невозможен, если ![]() <
< ![]() ;
;
при ![]() =
= ![]() коррозионная система находится в состоянии термодинамического равновесия.
коррозионная система находится в состоянии термодинамического равновесия.
Для случая стандартных условий в коррозионной системе возможность протекания коррозионного процесса при любой температуре определяется из уравнения
![]() (3.7)
(3.7)
или может быть оценена с помощью таблиц термодинамических функций веществ в стандартном состоянии с использованием соотношения:
![]() . (3.8)
. (3.8)
Весьма удобной характеристикой возможности течения реакции окисления, особенно для сложных коррозионных систем, является величина кислородного потенциала. Термодинамическим условием окисления является неравенство вида:
![]() , (3.9)
, (3.9)
где ![]() − кислородный потенциал газовой фазы;
− кислородный потенциал газовой фазы; ![]() − кислородный потенциал системы(
− кислородный потенциал системы(![]() ).
).
Расчет кислородных потенциалов газовой фазы и оксида металла производится из соотношений:
![]() , (3.10)
, (3.10)
![]() , (3.11)
, (3.11)
где ![]() − давление кислорода в газовой фазе;
− давление кислорода в газовой фазе;![]() − равновесное давление кислорода в системе (
− равновесное давление кислорода в системе (![]() ).
).












