4.11. Защита металлических материалов от коррозии в нейтральных аэрируемых средах
Для защиты металлических конструкций от коррозии в нейтральных аэрируемых средах (процессы электрохимической коррозии с кислородной деполяризацией) используются нижеследующие приемы.
1.Применение устойчивых металлов и сплавов
а) с повышенной термодинамической устойчивостью, например медь и сплавы на ее основе (латуни и бронзы), являющиеся достаточно устойчивыми в морской воде (j0Cu= + 0,35 B); медь применяют как в виде чистого металла, так и в виде сплавов с другими металлами – с цинком (латунь), цинком и алюминием, оловом или никелем (специальные латуни), оловом (оловянная бронза), алюминием (алюминиевая бронза), никелем (медно-никелевый сплав); медь широко используется как материал для арматуры водопроводных линий и отопительных систем;
б) склонные к пассивированию: алюминий (j0Al= - 1,67 B) и его сплавы (AlMn1, AlMn1Mg1, AlMgSi, AlZn5Mg1, AlZnMgCu и др.) пассивирующиеся в кислородосодержащих средах с образованием оксидной пленки из Al2O3 или Al2O3∙H2O (устойчив в средах с pH = 3-9); коррозионная устойчивость чистого алюминия понижается при наличии в нем катодных или анодных включений; титан (j0Ti= - 1,63B) и его сплавы, обладающие склонностью к переходу в пассивное состояние в нейтральных и окислительных средах, например в морской воде; легирование титана компонентами, повышающими анодную пассивируемость (Mo, Ta, Nb, Zr, Cr) или катодными добавками (Pd, Pt, Ru, Re), облегчающими переход в пассивное состояние, позволяет получать сплавы с высокой коррозионной устойчивостью не только в нейтральных средах, но и в растворахкислот; никель(j0Ni= - 0,25 B) и его сплавы с медью, молибденом и хромом которые в сильноокислительных средах пассивируются; эти сплавы устойчивы в щелочах различных концентраций, в растворах многих солей, в атмосфере и в природных водах; высокие прочностные и коррозионные свойства имеют сплавы никеля с медью – монели, содержащие около 30 % меди и 3…3 % марганца, алюминия, железа;
в)покрывающиеся защитными пленками вторичных, труднорастворимых продуктов коррозии (Zn в H2O, Pb в сульфатных растворах).
2.Удаление из электролита деполяризатора-кислорода (деаэрация электролита, обескислороживание
Деаэрируют воду, использующуюся для охлаждения паровых котлов, турбин, систем охлаждения металлургических агрегатов, термических печей и т.д.
Деаэрирование применяют для удаления из воды растворенного кислорода.
Различают:
- термическое деаэрирование, при котором воду оборабатывыают паром в отдельном агрегате; в основе метода лежит тот факт, что растворимость кислорода падает с ростом температуры;
- химическое деаэрирование, при котором растворенный в воде кислород удаляется посредством реакции с сульфитом натрия (Na2SO3) или гидразином (N2H4) по следующим уравнениям:
![]() . (4.21)
. (4.21)
3.Введение в электролит различных добавок, замедляющих течение коррозии
В одном случае это – торможение анодного процесса за счет введения в электролит веществ – пассиваторов (K2CrO4 ,NaNo2 и др.). Кроме того, используются вещества – ингибиторы коррозии (ИК). Они замедляют коррозию металлов в определенной коррозионной среде и придают им защитную способность при введении в вещества или материалы. Различают ингибиторы кислотной коррозии, растворов щелочей, неводных сред (бензин, нефть и другие), нейтральных сред и атмосферной коррозии.
В качестве ингибиторов коррозии для нейтральных сред применяют, в частности анодные ингибиторы, влияющие на анодную реакцию. Некоторые анодные ингибиторы, например хромат-ионы
(CrO42-) и нитрит-ионы (NO2-), а в присутствии воздуха фосфаты и молибдаты, действуют, вызывая образование защитного (пассивного) оксидного слоя на поверхности стали. Но, если концентрация ингибитора слишком мала, в оксидном слое могут возникать поры и дефекты, где может наблюдаться ускоренная коррозия. Поэтому такие ингибиторы называют "опасными ингибиторами".
4.Создание на поверхности металлических материалов защитных покрытий:
Металлических (Zn-,Cd-,Ni-,Pb - покрытия на поверхности стальных изделий);
По способу защитного действия металлические покрытия делятся на катодные и анодные.
Катодные покрытия из Pb,Cu,Ni созданные на поверхности стальных изделий защищают последние чисто механически, т.к. величина их электродного потенциала (jп) больше, чем у стали (jп > jFe ). Поэтому главное, предъявляемое к ним требование - их беспористость.
Анодные покрытия из Zn ,Cd , ввиду того, что jп < jFe, защищают изделие не только механически, но главным образом электрохимически, участвуя в анодном процессе вместо защищаемого стального изделия.
Основной метод создания металлических покрытий – гальванический. В последние годы широкое распространение получают методы напыления – плазменное, газофазное, термодиффузионное и др.
Неметаллических неорганических;
К неметаллическим неорганическим покрытиям относятся оксидные и фосфатные.
Оксидные покрытия создаются способом оксидирования – создание на поверхности защищаемого металлического изделия оксидной пленки, возникающей в процессе анодного растворения поверхности защищаемого металла.
Например, оксидирование алюминия сводится к реакции вида:
2Al + 3H20 = Al2O3 + 3H2. (4.22)
Оксидирование черных металлов – воронение. Его проводят химическим, термохимическим и электрохимическим способами. На железе и его сплавах образуется пленка магнитного оксида железа Fe3O4 . Ее стойкость невелика, поэтому она выполняет, в основном, декоративные функции.
Фосфатные покрытия создаются в процессе фосфатирования – обработки стальных и алюминиевых изделий в горячем растворе фосфорнокислых солей Fe,Zn . При этом на поверхности стального изделия образуется пленка труднорастворимых фосфатов (FeHPO4 или Fe3(PO4)2). Пленка пористая и хорошо “впитывает” масло и краску, надежно защищая сталь от коррозии. Фосфатированию главным образом подвергают сталь. Различают несколько вариантов процесса: чаще всего применяют цинковое фосфатирование, железное фосфатирование или натрийамонийное ; существует также марганцевое фосфатирование.
При цинковом фосфатировании
стальная поверхность обрабатывается в ванне, содержащей Н3РО4
,кислый фосфат, ионы цинка и некоторые добавки, например фториды, ионы никеля и органических соединений. При обработке происходит окисление и некоторое растворение железа с поверхности, а вблизи нее незначительно повышается рН. В результате на поверхности осаждаются труднорастворимые железо-цинковые или цинковые фосфаты. Масса покрытия в зависимости от условий, колеблется от 0,2 до 30 г/см3. Само по себе фосфатное покрытие слабо защищает от коррозии, но в сочетании с последующей пропиткой маслом дает хорошую защиту, так как пористое покрытие может поглощать значительное количество масла. Метод применяется для защиты оружия, перфораторов и некоторых деталей машин. Комбинация фосфатирования с противокоррозионным окрашиванием широко применяется для изделий из холоднокатаных стальных листов, например кузовов автомобилей.
Железное или натрийаммонийное фосфатирование применяется только для сталей. Его проводят в ванне, содержащей натрийдигидрофосфат (NaH2PO4) или аммонийдигидрофосфат (NH4H2PO4) при рН = 4,0…5,5. Образовавшееся покрытие состоит из фосфата железа (Fe3(PO4)2·8H2O), магнетита (Fe3O4) и некоторых железо-хромистых соединений – результат заключительной промывки раствором, содержащим хромовую кислоту – H2CrO4 и ионы Cr3+. Оно имеет массу от 0,2 до 1,0 г/м2 и в зависимости от условий может быть желто-зеленым, фиолетовым, синим или серым.
Железное фосфатирование проводят как подготовку под окрашивание для улучшения адгезии лакокрасочного слоя к основе. Метод применим для конструкций из листового металла, например, для бытовых машин.
Органических (лакокрасочные, асфальтобитумные, полиэтиленовые и другие покрытия).
5. Электрохимические способы защиты
В общем случае под электрохимической защитой понимается перевод металла в нереакционное состояние путем электродной поляризации.
Катодная защита
Катодная защита - способ предотвращения коррозии путем катодной поляризации со сдвигом его потенциала в отрицательную область. Катодная защита сводится к тому, что бы обеспечить на металлической поверхности возможность протекания преимущественно катодных процессов.
Основная идея метода, о чем уже указывалось выше, основывается на явлении катодной поляризации: защищаемое металлическое изделие (например, подземный продуктопровод) с помощью внешнего источника тока (катодной станции-выпрямителя) заполяризовывается до потенциала анода, т.е. до величины jоМе. (рис 4.5.).
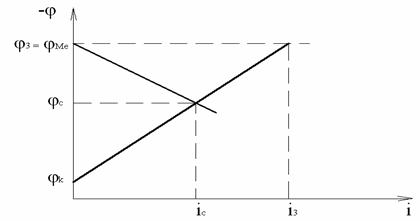
Рисунок 4.5 ― Поляризационные кривые, объясняющие принцип полной катодной защиты
В этом случае оба электрода – анод (металл) и катод (О2 или Н+) достигают одного и того же значения электродного потенциала и коррозия становится термодинамически невероятной (iз – плотность тока полной защиты). Если металлическое заполяризовать немного выше потенциала анода, то скорость коррозии также будет равна нулю, но большой ток может вызвать нарушение защитного асфальтобитумного покрытия, поэтому на практике силу тока поддерживают близко к теоретическому максимуму.
Схема катодной защиты (рис.4.6) работает следующим образом. Отрицательный полюс внешнего источника тока (…) – станции катодной защиты, присоединен к защищаемой металлической конструкции (…), а положительный – к вспомогательному электроду (…), работающему как анод. В процессе коррозии анод разрушается и подлежит восстановлению. В качестве материала анода используется чугун, сталь, уголь, графит, металлический лом.
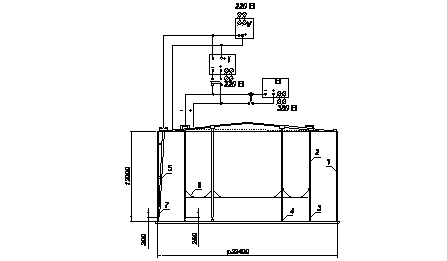
Рисунок 4.6 ― Схема анодной защиты хранилища аммиачной воды :
1 – хранилище; 2 – катоды; 3 – втулка; 4 – пруток; 5 – трубка для висмутового электрода; 6 – опоры катодов; 7 – гнездо электрода сравнения.
Катодная защита эффективна тогда, когда коррозионная среда весьма электропроводна.
Протекторная защита
Метод также основан на явлении катодной поляризации, но без участия внешнего источника электрического тока (рис. 4.7).
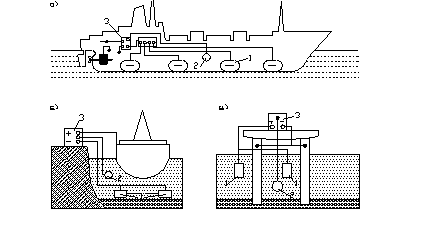
Рисунок 4.7 ― Принципиальные системы катодной защиты с применением источника тока: а – автономная судов; б – береговая судов; в – гидротехнических сооружений;
1 – аноды; 2 – электроды сравнения; 3 – источник питания; 4 – контактно-щеточное устройство.
В этом случае к защищаемой конструкции (1) присоединяют металл – протектор (2) с меньшим, чем у защищаемого электродным потенциалом. Протектор, растворяясь в коррозионной среде (3), снабжает конструкцию электронами, катодно заполяризовывая ее. Протектор периодически возобновляется. В качестве протектора используют магний, цинк и их сплавы. Протекторная защита организуется тогда, когда получение энергии извне затруднено или экономически нецелесообразно. Протекторная защита широко используется при защите корпусов судов, автомобилей.
Анодная защита
Анодная защита – способ предотвращения коррозии путем анодной поляризации металла со сдвигом его потенциала в положительную сторону. Анодная защита сводится к тому, чтобы обеспечить создание на поверхности металла защитной пассивирующей пленки.
Принцип анодной защиты состоит в том, что защищаемую конструкцию присоединяют к положительному полюсу внешнего источника тока, а вспомогательный электрод - к отрицательному. При этом происходит смещений электродного потенциала защищаемой конструкции в пассивную область. Схема анодной защиты приведена на рис.4.8. Анодную защиту могут осуществлять и с помощью протекторов, имеющих при катодной защите потенциал более отрицательный, а при анодной – более положительный.
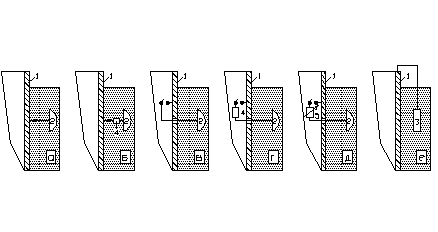
Рисунок 4.8 ― Принципиальные электрические схемы протекторной защиты:
а – короткозамкнутая; б – не отключаемая с балластным сопротивлением; в – отключаемая нерегулируемая; г – отключаемая с балластным сопротивлением; д – отключаемая регулируемая; е – с подвесными протекторами; 1 – защищаемая конструкция; 2 – протектор стационарный; 3 – протектор подвесной; 4 – постоянное балластное сопротивление; 5 – переменное балластное сопротивление.
Поскольку скорость коррозии в пассивном состоянии мала, то расход электроэнергии при анодной защите значительно меньше, чем при катодной (10-1 … 10-4 А/м2). В зависимости от агрессивности среды, применяются катоды из кремнистого чугуна, молибдена, сплавов титана, из нержавеющих и углеродистых сталей, из никеля. Расположение катодов должно обеспечить наиболее равномерное распределение тока на защищаемой поверхности.
Анодная защита – сравнительно новый метод активной электрохимической защиты от коррозии, благодаря фундаментальным исследованиям по теории пассивности академика Я.М. Колотыркина и его школы.
Метод анодной защиты сейчас находится в стадии широкого промышленного внедрения. Получены хорошие результаты по защите от коррозии различного оборудования, изготовленного из нержавеющих сталей в растворах серной кислоты и других агрессивных средах. В частности, анодную защиту успешно применяют для защиты теплообменной аппаратуры из стали 1Х18Н10Т в 70…80% - ной серной кислоте при 100…120єС (а из стали Ст.3 при температуре до 90°С), цистерн для перевозки серной кислоты, в том числе особо чистой и др. Эффективно использование анодной защиты для цистерн, используемых для перевозки азотных удобрений и хранилищ жидких углеаммонийных удобрений, содержащих аммиачную селитру, выполненных из стали Ст.3.
Условиями для дальнейшего широкого внедрения анодной защиты являются: автоматизация технологических процессов и производство высоконадежных средств регулирования и контроля потенциала, так как анодная защита потенциально опасна – в случае перерыва в подаче тока возможно активирование металла и его активное анодное растворение. Поэтому за работой системы анодной защиты требуется тщательный контроль.











