4.12.2. Схема и стадии процесса коррозии с водородной деполяризацией
Катодный процесс с водородной деполяризацией состоит из ряда стадий (рис.4.9):
- подвод (конвекция и диффузия) гидратированных ионов водорода (H+∙H2O) к катодным участкам поверхности корродирующего металла;
- разряд водородных ионов в соответствии с реакцией Н×H2O + + e - = Hадс + H2O;
- растворение части адсорбированных атомов водорода (Hадс) в металле;
- рекомбинация водородных атомов по реакции Hадс + Hадс = H2;
- отвод молекул водорода от катодных участков в объем электролита и их выделение в атмосферу;
- образование и отрыв пузырьков водорода (n∙H2)от поверхности металла в соответствии с реакцией H2 + H2 + ... = nH2 .
Катодный процесс может тормозиться на стадиях химических реакций, что приводит к возникновению электрохимической поляризации называемой перенапряжением водорода (hН2).
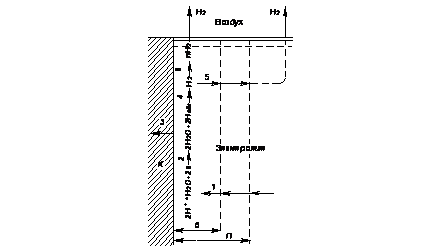
Рисунок 4.9 ― Схема катодного процесса с водородной деполяризацией
Предложено много теорий перенапряжения водорода, но наиболее значимыми являются теория замедленного разряда и замедленной рекомбинации.
Теория замедленного разряда была выдвинута Колли, развита и усовершенствована Фрумкиным А.Н. Основная идея – затрудненность отделения ионов водорода от молекул воды, то есть торможение реакции:
![]() .
.
Зависимость перенапряжения от плотности катодного тока выражается уравнентем вида:
![]() , (4.26)
, (4.26)
где a,b – постоянные; ik – плотность катодного тока.
Для малых значений катодной поляризации уравнение ![]() имеет вид:
имеет вид:
![]() . (4.27)
. (4.27)
Теория замедленного разряда дает хорошее соответствие в опытным данным, объясняет зависимость ![]() и строение двойного электродного слоя.
и строение двойного электродного слоя.
Теория замедленной рекомбинации предложена Тафелем в 1900г. В рамках этой теории ответственность за перенапряжение водорода несет реакция молизации (рекомбинации) атомов водорода:
![]() . (4.28)
. (4.28)
Доводом в пользу этой теории является совпадение ряда металлов по возрастающим значения перенапряжения водорода с расположением металлов по убывающей каталитической активности при рекомбинации водородных атомов:
Pt, Pd, W, Ni, Fe, Ag, Cu, Zn, Sn, Pb, Hg.
Изложенные две теории перенапряжения водорода не являются взаимоисключающими – они дополняют друг друга. Есть основания полагать, что для металлов с очень высоким перенапряжением, ответственным за перенапряжение является замедленный разряд, а для металлов с низким перенапряжением – рекомбинация, а для железа, никеля, титана – замедленность обеих стадий.
Торможение реакции рекомбинации атомов водорода увеличивает возможность растворения водорода в металле, его диффузии вглубь и появление водородной хрупкости – весьма опасного вида коррозионного разрушения.
Если катодный процесс тормозится на стадиях массопереноса, то возникает концентрационная поляризация ![]() Различают ионную и газовую концентрационную поляризацию.
Различают ионную и газовую концентрационную поляризацию.
Ионная концентрационная поляризация – следствие торможения процесса транспорта ионов водорода к катодным участкам, а газовая – следствие торможения процесса отвода молекулярного водорода от катодных участков в объем электролита. В отличие от ионной, газовая концентрационная поляризация постоянно сопровождает процесс водородной деполяризации и всегда довольно значительна.
Подводя итог изложенному выше, необходимо отметить следующие основные положения. В неокислительных кислотах лимитирующей стадией процесса коррозии является процесс катодной деполяризации – восстановления водорода на катодных участках поверхности корродирующего металла. Для кислородсодержащих растворов кислот лимитирующей стадией процесса коррозии является анодный процесс, вследствие возможного образования пассивных слоев. По этой причине железо не корродирует в растворах азотной кислоты концентраций 50…60 % (масс.).












