4.9. Пассивность металлов
Явление пассивности металлов открыто более двух веков назад, но продолжает активно изучаться, так как имеет огромное практическое значение.
Пассивность - это состояние относительно высокой коррозионной стойкости металла, вызванное торможением анодного процесса.
К переходу в пассивное состояние склонны все конструкционные металлы − Fe,Cr,Ni,Ti,Al,Мg и многие другие.
Как правило, пассивное состояние наступает при контакте металлов с сильными окислителями: кислородом, пероксидом водорода, ионами хромата CrO42-, бихромата Cr2O72-, и другими. Для титана таким эффективным окислителем является вода.
Пассивное состояние металла можно вызвать путем смещения его электродного потенциала в положительную область с помощью внешнего источника тока. При этом регистрируют кривые анодной поляризации или потенциостатические кривые. Эти кривые имеют четыре характерных области (рис.4.3):
I − область активного растворения металла; при значении потенциала, равного цквозможна адсорбция кислорода на поверхности металла, что приводит к торможению анодной реакции в местах осаждения кислорода; с изменением потенциала от цк до цп происходит наряду с растворением, формирование защитной пленки адсорбционного или оксидного типа на металлах, способных пассивироваться в данном растворе;
II − область формирования пассивного состояния, которое наступает после достижения потенциала пассивации jпи плотности тока пассивации iп; при этом реализуется так называемый пленочно-адсорбционный механизм возникновения пассивного состояния, связанный с возникновением на поверхности металлического материала, например , оксидов Fe2O3,Fe8O11 , слоя адсорбированного кислорода (Оадс) и других образований.
III − область пассивности, наступающая при достижении потенциала полной пассивации jп.п..
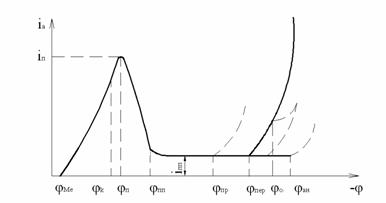
Рисунок 4.3 ― Принципиальная анодная поляризационная кривая пассивирующегося металла
В этой области скорость растворения метала минимальна и определяется плотностью тока полной пассивации iп.п ;
Если в коррозионной среде присутствуют активные ионы, например
Cl-, то состояние пассивности преждевременно нарушается. Это происходит при потенциале пробоя (jпр ) − происходит прорыв пассивной пленки ,сформировавшейся во второй области. При этом характер разрушения металла – питтинговая коррозия.
IV − область перепассивации, начинающаяся по достижении потенциала перепассивации jпер. Скорость коррозии вновь возрастает при увеличении потенциала анода.
В тех случаях, когда для метала не характерно явление перепассивации, связанное с его переменной валентностью, смещение потенциала в положительную сторону может вызвать выделение кислорода по реакции:
![]() (4.12)
(4.12)
либо протекание процесса анодирования – образования нового толстого слоя оксида на поверхности защищаемого металла. Первый из этих процессов начинается при достижении равновесного значения потенциала ![]() , а второй- значения потенциала
, а второй- значения потенциала ![]() .
.
Для практических целей желательно, чтобы область пассивного состояния была, по возможности шире, то есть чтобы интервал jп.п …jпер. был достаточно велик, а величины iп и iп.п - весьма малы.
Легирующие элементы, вводимые в сталь, по-разному влияют на характерные точки анодной поляризационной кривой (табл. 4.1).
Таблица 4.1 − Влияние легирующих элементов на характерные точки кривой анодной поляризации
|
Элемент |
jп |
jп.п |
jпр |
jпер |
iп.п |
|
Хром |
Ü |
Ü |
Þ |
Ü |
ß |
|
Никель |
Û |
Þ |
Þ |
Þ |
ß |
|
Молибден |
Û |
Ü |
Þ |
Ü |
Ý |
|
Кремний |
¾ |
Ü |
Þ |
Þ |
ß |
|
Ванадий |
¾ |
¾ |
Þ |
Ü |
Ý |
Пояснения к таблице:
знак Þ означает смещение потенциала в положительную сторону; знак Ü означает смещение потенциала в отрицательную сторону; знак Ý или ß означает увеличение или уменьшение плотности тока соответственно; знак Û − противоречивые данные.
Наиболее подробно процесс пассивации исследован для железа в однонормальном растворе H2SO4 при25°С. Наиболее вероятный состав образующегося пассивного слоя – смешанный оксид Fe2O3 и Fe3O4. Толщина пассивного слоя на железе в кислых растворах находится, по данным различных измерений, в пределах 3 – 5 нм, увеличиваясь с ростом потенциала.
Аналогично железу, хрому и никелю пассивируются высоколегированные хромистые и хромоникелевые стали. Определяющим элементом является хром: стали с содержанием хрома менее 10% по свойствам близки к железу, тогда как стали с содержанием хрома 15% и более ближе к хрому.
Легирование сталей молибденом в количестве 2 – 3% увеличивает способность к созданию более устойчивого пассивного состояния.
Наиболее устойчивой пассивностью оксидного типа обладают титан и его сплавы. Вследствие образования на его поверхности плотной защитной пленки TiO2, титан в отличие от железа, никеля, хрома и нержавеющих сталей, устойчив в нейтральных и слабокислых растворах хлоридов при повышенных температурах, а также в растворах окислителей. Это определяет возможность его широкого использования в различных отраслях промышленности, где требуется высокая коррозионная устойчивость в сочетании с удельной прочностью.
Явлению пассивности обязано и широкое промышленное применение алюминия. Вследствие образования на его поверхности пленки Al2O3 или Al2O3∙H2O, алюминий достаточно устойчив в воде, большинстве нейтральных и многих слабокислых растворах, а также в атмосфере. Защитная пленка на алюминии имеет амфотерный характер – она растворяется в сильных неокисляющих кислотах и особенно легко в щелочах.
Примером солевой пассивности является поведение цинка в атмосфере и в нейтральных водных растворах.
При особом виде электрохимической коррозии - межкристаллитной коррозии (МКК), активному растворению подвергаются границы зерен, обедненные хромом (менее 10 – 14 %) вследствие образования при охлаждении карбидов хрома. Мерами борьбы являются закалка, снижение содержания углерода до 0,01 – 0,03 %, легирование стали карбидообразующими элементами (титан, цирконий).
Нарушение сплошности пассивной пленки на неметаллических включениях при воздействии ионов галогенидов является причиной язвенной и питтинговой коррозии. Язвенная коррозия характерна для нержавеющих сталей, алюминиевых сплавов, медных сплавов при высоких скоростях движения воды. С повышением температуры растворов, в частности хлоридных, снижается устойчивость пассивного состояния нержавеющих сталей.












