Коррозионный гальванический элемент
При электрохимической коррозии протекают два, процесса — катодный и анодный, которые образуются на различных участках металлической поверхности. При этом катодные и анодные участки пространственно разделены (локализованы). Локализация анодных и катодных участков вызывается неоднородностью: присутствием в металле незначительных примесей, структурных составляющих сплавов; неравномерным распределением собственных ионов металла, ионов водорода, кислорода и др. возле корродирующей поверхности; неравномерным нагревом различных участков поверхности и наложением внешнего электрического поля; неоднородностью поверхности металла, обусловленной дефектами защитных пленок, продуктов коррозии неравномерной деформацией, неравномерностью приложенных внешних нагрузок.
В общем случае локализация процессов происходит на участках отличающихся физическими и химическими свойствами.
Модель коррозионного элемента показана на рис2. Выделяют три основные стадии коррозионного процесса.
1. Анодный процесс — переход ионов металла в раствор и гидратация с образованием некомпенсированных электронов на анодных участках по реакции
Ме + nН2О → Меz+ + nН2О + ze.
2. Процесс электропереноса — перетекание электронов по металлу от анодных участков к катодным и соответствующее перемещение катионов в растворе.
3. Катодный процесс — ассимиляция электронов каким-либо деполяризатором — ионами и молекулами, находящимися в растворе и способными восстанавливаться на катодных участках по реакции
D + z ![]() → [D z
→ [D z ![]() ].
].
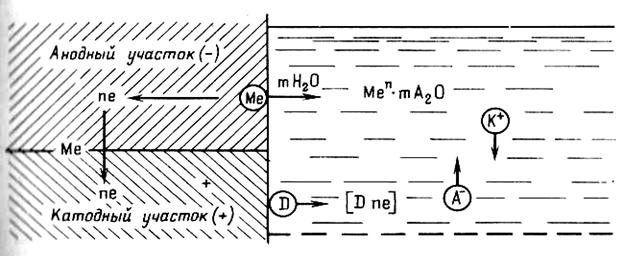
Рис. 2. Схема электрохимического коррозионного процесса
Если процесс деполяризации происходит за счет восстановления кислорода, то коррозионный процесс идет с кислородной деполяризацией
О2 + 2Н2О + 4![]() → 4ОН-.
→ 4ОН-.
Если деполяризатором служат ионы водорода, то процесс идет с водородной деполяризацией
Н+ + ![]() → Н,
→ Н,
Н + Н → Н2 → Н2↑.
Особенности электрохимического процесса коррозии следующие:
- одновременное протекание катодного и анодного процессов;
- зависимость скорости коррозии, обусловленной механизмом электрохимических процессов, от электродного потенциала металла;
- возможность локализации электродных процессов на различных участках поверхности корродирующего металла, где их протекание облегчено;
- реализация материального эффекта коррозии (растворение металла) на анодных участках при локализации электродных процессов.
Контролирующий фактор электрохимической коррозии, определяющий ее скорость, — поляризация электрода — изменение разности потенциалов коррозионного элемента, приводящее к уменьшению силы тока. Поляризация тормозит скорость протекания электрохимической коррозии металлов. Основная причина поляризации — отставание электродных процессов (катодного и анодного) от перетока электронов в металле. Так, если анодный процесс отстает от перетока электронов от анода к катоду, то происходит уменьшение отрицательного заряда на поверхности электрода. Потенциал анода при этом становится положительнее. Катодный процесс отстает от поступления электронов на катод, происходит увеличение отрицательного заряда на поверхности электрода, что приводит соответственно к сдвигу потенциала катода в отрицательную сторону.
При графическом изображении зависимости потенциала электрода от плотности тока с помощью поляризационных кривых наглядно видно, что при катодной поляризации происходит рост потенциала, а при анодной — его снижение (рис. 3). Чем круче поляризационная кривая, тем больше величина поляризационного сопротивления и тем труднее протекает коррозионный процесс. При пологих поляризационных кривых происходит малая поляризация и легче протекает коррозионный процесс. Скорость коррозии уменьшается как вследствие поляризации анода, так и катода.
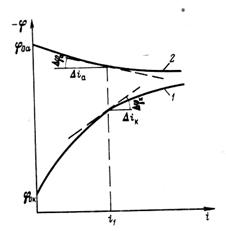 |
Рис. 3. Поляризационные кривые:
1 —анодная; 2 — катодная
В общем случае скорость электрохимического коррозионного процесса можно выразить следующим соотношением:
![]()
где I — сила коррозионного тока; φко – φао — разность начальных потенциалов катода и анода, являющаяся движущей силой коррозионного процесса, характеризует термодинамическую возможность протекания электрохимической коррозии; R- омическое сопротивлении коррозионного элемента; Рк, Ра- поляризационное сопротивления катодного и анодного процессов соответственно (сопротивление протеканию электродных процессов). Оно имеет смысл для линейной! поляризации (линейной зависимости тока от потенциала).
При нелинейной зависимости тока от потенциала используют понятие поляризуемости
Р'к = Δφк/Δiк; Р'а = Δφа/Δiа.
Эти величины — отношение величины смещения потенциала к плотности или приращению плотности тока. Омическое сопротивление учитывает сопротивление электролита.
Снизить скорость коррозии можно при:
- уменьшении степени термодинамической нестабильности — сближении потенциалов катодного и анодного процессов;
- увеличении катодной поляризуемости Р, приводящем к торможению катодного процесса;
- увеличении анодной поляризуемости Р, приводящем к торможению анодного процесса;
- увеличении омического сопротивления R.
Торможение коррозионного процесса по одному из указанных Путей определяет вид контроля.
Различают коррозию, протекающую с катодным, анодным или омическим контролем. В практике нефтяной промышленности встречаются в основном процессы с катодным контролем.
Электродные процессы, уменьшающие поляризацию на аноде и Катоде, называются процессами деполяризации, а вещества, препятствующие поляризации, — деполяризаторами. На практике встречаются и в основном процессы коррозии с кислородной и водородной деполяризацией.
При коррозии с водородной деполяризацией на катоде протекает реакция разряда ионов гидроксония по схеме
2Н3О+ +2![]() → 2Н2О + Н + Н → 2Н2О + Н2↑.
→ 2Н2О + Н + Н → 2Н2О + Н2↑.
Катодный процесс водородной деполяризации состоит из: диффузии ионов гидроксония к катоду с последующим их разрядом и образованием водородных атомов, адсорбирующихся на металле; полязации водородных атомов с образованием молекулярного водорода, который, в свою очередь, диффундирует и переносится конвекцией от катодных участков в раствор. Часть адсорбированных атомом водорода диффундирует в металл, вызывая явление водородного охрупчивания.
Процессы водородной деполяризации характерны в основном для технологических процессов, протекающих в кислых средах.
Коррозия с кислородной деполяризацией — наиболее распространенный процесс, так как по этому механизму корродируют металлы в водных средах, влажной атмосфере, почве. Катодный процесс кислородной деполяризации заключается в ионизации кислорода на катоде. Причем в зависимости от рН среды будут различными конечные продукты ионизации. При рН > 7 ионизация кислорода на катоде протекции по схеме
О2 + 4![]() + 2Н2О → 4ОН-
+ 2Н2О → 4ОН-
, при рН < 7 — по схеме:
О2 + 4![]() + 4Н+ → 2Н2О.
+ 4Н+ → 2Н2О.
Катодный процесс коррозии с кислородной деполяризацией имеет последовательные стадии: прохождение кислорода через поверхность раздела воздух—электролит; перенос растворенного молекулярного кислорода в объеме электролита при механическом перемешивании, конвекции и диффузии к катодным участкам поверхности; перенос кислорода в диффузионном слое; ионизация кислорода; диффузия и конвективный перенос ионов ОН= от катодных участков поверхности металла в электролит.
Коррозия зависит от нескольких факторов. Скорость электрохимической коррозии металлов существенно зависит от температуры, с ее повышением скорость растет. При нейтральных значениях рН для процесса коррозии с кислородной деполяризацией зависимость скорости коррозии от температуры носит сложный характер. Это связано с тем, что с повышением температуры уменьшается растворимость кислорода. В открытых аэрируемых системах скорость коррозии железа с ростом температуры в пределах от 293 до 353 К возрастает и далее уменьшается вследствие резкого снижения концентрации кислорода. В закрытой системе, когда кислород не может выделяться из раствора скорость коррозии железа непрерывно растет с повышением температуры.
В минерализованных средах скорость коррозии стали растет с увеличением скорости движения среды из-за усиления подачи кислорода к металлической поверхности. В пресной воде при скорости движения среды до 0,4 м/с скорость коррозии стали заметно возрастает вследствие облегчения диффузии кислорода к металлической поверхности. С ростом скорости движения насыщенной кислородом среды до 0,8—0,9 м/с скорость коррозии снижается в результате образования пассивной пленки на металле при достаточно обильном пoступлении кислорода. При дальнейшем увеличении скорости движения среды происходит разрушение защитной пленки и самого металла в результате коррозионно-эрозионных и кавитационных процессов. Скорость коррозии при этом растет.
Давление в значительной степени ускоряет электрохимическую коррозию металлов из-за повышения растворимости деполяризаторов коррозионного процесса (кислород, сероводород и др.) и появления механических напряжений в металле.
Поляризация корродирующего металла внешним постоянным током влияет на коррозионное разрушение металлов: при анодном поляризации металла (подключении его к положительному полюсу внешнего источника тока) скорость коррозии увеличивается, при катодной поляризации в большинстве случаев наблюдается защитный эффект, т.е. скорость коррозии металла уменьшается.
Скорость коррозии зависит от рН среды, возрастая по мере подкисления среды, если не происходит пассивирования металла. В нейтральных средах скорость коррозии железа слабо зависит от изменения величины рН. При возрастании рН скорость коррозии железа и стали уменьшается.
Наличие в среде микроорганизмов и продуктов их жизнедеятельности оказывает существенное влияние на характер коррозионных разрушений металлов. При микробиологической коррозии коррозионные поражения носят локальный характер, скорость коррозии достигает значительных величин.
Внутренняя электрохимическая коррозия металлов связана с природой металла, его составом, структурой, состоянием поверхности, напряжениями в металле, а также с термодинамической устойчивостью металла и его местом в периодической системе элементов. Так, металл, нестойкий в одних условиях, в других условиях оказывается стойким. Это обусловлено тем, что протекание термодинамически возможного процесса бывает заторможено образующимися пассивными пленками, труднорастворимыми продуктами коррозии.
Термодинамическая устойчивость выше у металлов с более положительным равновесным потенциалом. Для оценки коррозионного процесса необходимо знать кинетику катодного и анодного процессов. Скорость и характер коррозии металлов в электролитах зависят структуры, состояния исходной поверхности металла, различных и воздействия механического фактора.
Тщательно отполированная поверхность металла придает ему коррозионную устойчивость в агрессивных средах, так как облегчается образование более совершенных и однородных защитных пленок, в том числе не и пассивных.
На процесс коррозии металлов оказывают влияние кристаллическая структура металлов и наличие различных структурных дефектов. Установлено, что скорость коррозии увеличивается при низкой плотности упаковки атомов и кристаллографической плоскости, неупорядоченности атомов кристаллической решетки, дефектах ее структуры. Структурная гетерогенность сплава во многом предопределяет развитие электрохимической коррозии. В отличие от однородных сплавов гетерогенной структуры менее стойки к коррозии. Скорость коррозии уменьшается, если анодная фаза гетерогенной структуры способна пассивироваться. После растворения анодной фазы в поверхностном слое сплав приобретает практически однофазную структуру. Если заметно коррозирует и катодный компонент сплава, то возможно вторичное (контактное, т.е. без тока внешней поляризации) выделение благородного компонента на поверхности сплава в виде несплошного пористого покрытия. Коррозия при этом усиливается. Величина зерна в некоторой степени влияет на скорость коррозии. При утолщении и загрязнении границ его примесями увеличивается микроэлектрохимическая гетерогенность и может начаться процесс межкристаллитной коррозии.
Значительное число металлических изделий эксплуатируется в условиях одновременного воздействия коррозионной среды и механических напряжений. Опасность коррозионно-механического воздействия заключается в том, что при значительной скорости общей коррозии происходит полное разрушение металлического изделия. Под влиянием коррозионной среды и деформации металла возможны образование коррозионно-механических трещин, понижение предела коррозионной усталости, разрушение металла вследствие механического воздействия агрессивной среды, коррозионная кавитация и другие процессы.












