Основные закономерности синтеза карбамидоформальдегидных олигомеров
Поликонденсация карбамида с формальдегидом проходит в несколько стадий. Присоединение формальдегида к карбамиду (гидроксиметилирование) с образованием метилольных производных карбамида. Последующая конденсация метилольных производных карбамида.
Карбамид имеет два реакционных центра (H2N-CO-NH2) и теоретически может присоединить до четырех молекул формальдегида.
При проведении реакции в нейтральной или щелочной среде (рН ³ 7) первоначальными продуктами взаимодействия карбамида с формальдегидом являются метилольные производные:
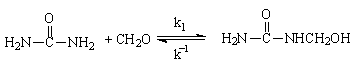
Монометилолкарбамид
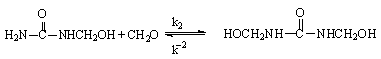
Сим-диметилолкарбамид
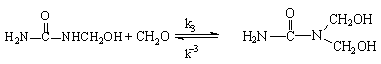
Асим-диметилолкарбамид
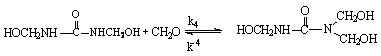
Триметилолкарбамид
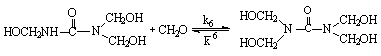
Тетраметилолкарбамид
При 40°С (рН = 7) константы равновесия, л/моль:
К1 = 1×10-3; К2 = 2,5×102; К3 = 0,2×102; К4 = 0,2×102; К5 = 2×102;
К6<<К4.
Как видно, все эти реакции (кроме образования монометилолкарбамида) являются практически обратимыми. Из-за низкой величины константы равновесия К6 вероятность образования тетраметилолкарбамида невелика.
Основной катализ взаимодействия карбамида с формальдегидом особенно эффективен при рН > 8. Он сводится к активированию низкомолекулярного агента (карбамида) за счет отрыва протона от атома азота с образованием соответствующего аниона:
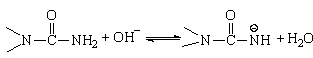
,который затем легко реагирует с формальдегидом:
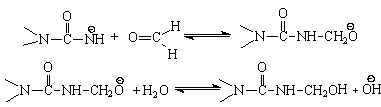
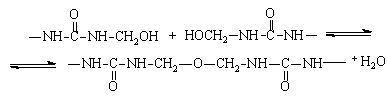
Метилольные производные карбамида при рН³7 относительно устойчивы вплоть до температуры порядка 60°С. При более высокой температуре они конденсируются с образованием диметиленэфирной связи:
Эта реакция не подвержена основному катализу.
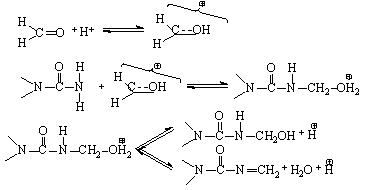
Принципиально возможен кислотный катализ реакции карбамида с формальдегидом. Карбамид реагирует с протонированной молекулой формальдегида. При этом могут образоваться не только метилольные производные карбамида, но и метиленкарбамид:
Метиленкарбамид – побочный продукт, не участвующий в образовании олигомера, содержание его в составе продуктов реакции определяется величиной рН и типом растворителя. В безводных средах и при низких величинах рН метиленкарбамид – основной продукт реакции. При проведении реакции в водной среде и при более высоких значениях рН (рН = 4) доля метиленкарбамида снижается, но все же остается довольно высокой. В водной среде возможен гидролиз метиленкарбамида, но степень его незначительна из-за плохой растворимости метиленкарбамида в воде.
В то же время образующиеся метилольные производные в кислой среде являются соединениями неустойчивыми и легко конденсируются. Конденсация метилольных производных подвержена кислотному катализу, и скорость ее резко возрастает при снижении рН от 7 до 2.
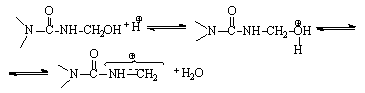
Сущность кислотного катализа сводится к протонированию метилольной группы и образованию катиона с делокализованным положительным зарядом, способного легко реагировать с амино-, имино - и метилольными группами:
Реакция с амино - и иминогруппами карбамида приводит к образованию продуктов с метиленовыми мостиками (1):
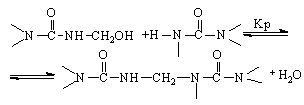
А реакция с метилольными группами – к образованию продуктов с метиленэфирными мостиками (2):
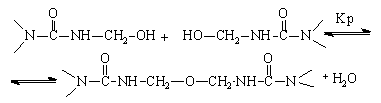
При рН < 4 преобладает реакция (1), приводящая к возникновению метиленовых связей, а при 4 < рН < 7 образуются как метиленовые, так и диметиленэфирные связи (1, 2).
Рассмотренные закономерности реакции карбамида с формальдегидом лежат в основе технологии процессов получения карбамидоформальдегидных олигомеров.
Синтез олигомеров проводят в две стадии.
Вначале, на первой стадии, получают метилольные производные карбамида. Исходные вещества – формальдегид и карбамид берут в мольном соотношении 2,5/1, при котором карбамид полностью вступает в реакцию, причем основными продуктами гидроксиметилирования являются три - и диметилолкарбамиды. Формальдегид обычно используют в виде водного раствора – формалина. Реакцию ведут в нейтральной или слабощелочной среде.
При проведении процесса необходимо тщательно следить за величиной рН, поскольку может произойти довольно быстрое его снижение до 6 за счет протекания побочных реакций с участием формальдегида, особенно легко происходящих в щелочной среде.
Это реакция Каниццаро:
![]()
,а также окисление формальдегида кислородом воздуха:
![]()
В средах, близких к нейтральным, доля этих реакций сводится к минимуму. Поэтому рН обычно поддерживают на уровне 7-7,5 добавлением аммиака или триэтаноламина. Гидроксиметилирование карбамида проводят при температуре до 60°С, при которой скорость конденсации метилольных производных сравнительно невысока. Реакцию ведут практически до полного израсходования карбамида. Проведение этой стадии в кислой среде нецелесообразно, поскольку при кислотном катализе реакция осложняется получением метиленкарбамида.
Вторую стадию процесса – конденсацию метилольных производных - проводят при рН < 7 (кислотный катализ, эффективный при этой реакции). Поскольку при низких значениях рН конденсация протекает слишком быстро даже при комнатной температуре и трудно поддается контролю, чаще всего ее проводят при рН 4,5-6 и умеренных температурах (70-90°С). Подкисление реакционной массы, учитывая относительно высокую величину рН, проводят слабыми карбоновыми кислотами – щавелевой, муравьиной и др.
Равновесный характер реакций конденсации метилольных производных обуславливает необходимость достаточно полного удаления воды из реакционной системы. Удаление воды осуществляется отгонкой, причем эту операцию нельзя считать только осушкой, поскольку при ее проведении происходит дальнейшее углубление процесса поликонденсации олигомера за счет сдвига равновесия реакций (1) и (2) в правую сторону.












